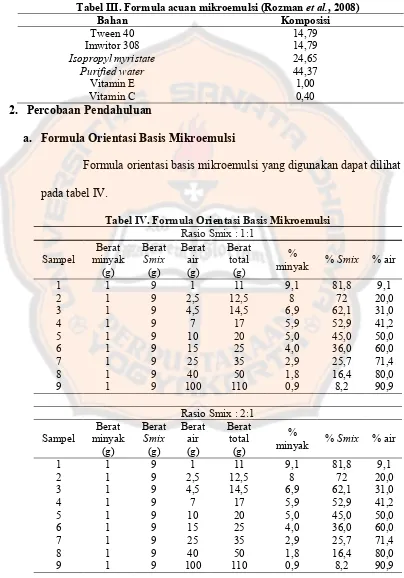
Pengaruh perbandingan Surfaktan Tween 80 dan kosurfaktan PEG 400 dalam formulasi sediaan mikroemulsi askorbil palmitat dan alfa tokoferol untuk antiaging - USD Repository
Teks penuh
Gambar

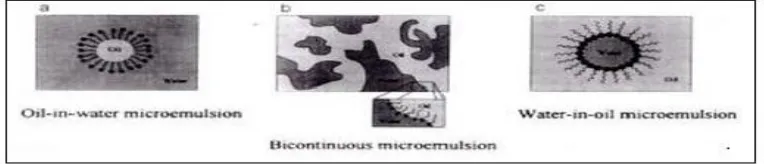

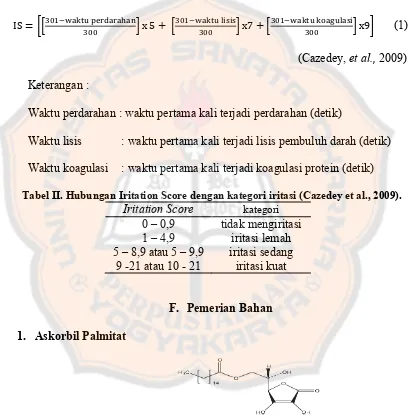
Dokumen terkait
Riau Pos Intermedia mengalami peningkatan dan penurunan (fluktuasi) setiap tahunnya. Jumlah masuk dan keluar karyawan pada PT. Riau Pos Intermedia menunjukkan bahwa
1. Melakukan analisis dan perancangan sistem. Implementasi dan pembahasan sistem. b) Aplikasi Kamera Pemantau berbasis Android ini dapat dijalankan pada telepon genggam
Evaluasi pemahaman visi misi dilaksanakan untuk mengukur tingkat pemahaman pemangku kepentingan (stake holder) dosen, tenaga kependidikan, mahasiswa, alumni, dan
Kepercayaan merek atau brand trust merupakan kemampuan suatu merek untuk dipercaya atau brand reiability yang berdasar dan berlandaskan keyakinan konsumen atau
Jenis bisnis yang pertama kali ditawarkan pada produk pakaian saudara/i. Apakah bisnis berbasis online, Atau
dapat dilihat dengan nyata; proses situ terjadi dalam diri seseorang yang sedang..
Dengan ini kami menyatakan bahwa artikel yang berjudul Kesetimbangan Energi Dan Massa Pada Ruang Pengering Alat Pengering Tipe Fluidized Beds Pada Pengeringan
Jumlah populasi terendah dari hama yang menyerang pada beberapa varietas kedelai fase vegetatif yaitu pada lalat bibit dengan jumlah populasi yaitu 10 ekor