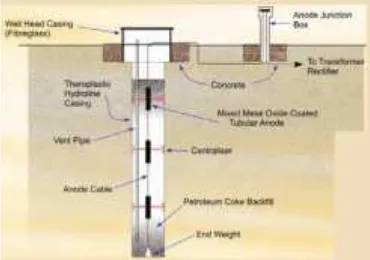
PERANCANGAN SISTEM PROTEKSI KATODIK ARUS PAKSA PADA PIPA BAJA API 5L GRADE B DI DALAM TANAH DENGAN VARIASI JENIS COATING
Teks penuh
Gambar

Garis besar
Dokumen terkait
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa pengaruh dari resistivitas tanah yang semakin besar, akan menyebabkan kebutuhan arus proteksi yang
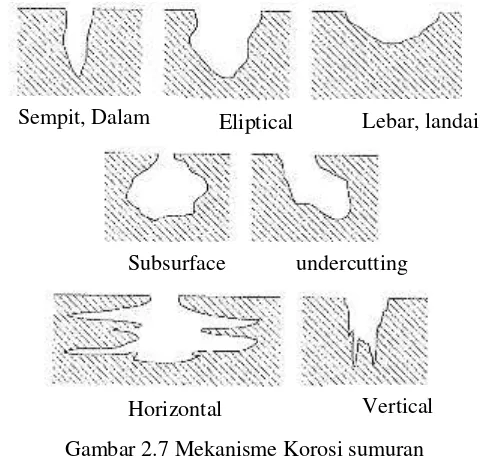
Korosi dapat didefinisikan sebagai kerusakan dari material karena reaksi dengan lingkungan disekitarnya. Beberapa menyebutkan bahwa definisi ini hanya dibatasi untuk
Pada penelitian yang dilakukan kali ini akan mempelajari mengenai pengaruh dari variasi luas goresan lapis lindung dan pH tanah terhadap kebutuhan arus proteksi
Dari hasil pengukuran arus porteksi yang didapatkan selama 7 hari proses pengukuran, dapat dilihat bahwa dalam lingkungan elektrolit yang sama (pH sama), semakin
Metode pengukuran yang digunakan mengacu pada half-cell (potensial elektroda setengah sel) dengan elektroda acuan Cu/CuSO4. Dari hasil pengukuran potensial awal yang
Dari hasil pengukuran arus porteksi yang didapatkan selama 7 hari proses pengukuran, dapat dilihat bahwa dalam lingkungan elektrolit yang sama (pH sama), semakin