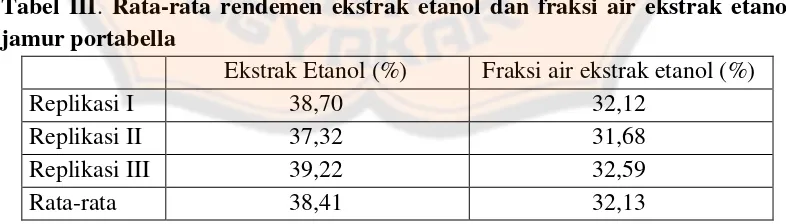
Uji aktivitas antibakteri fraksi air ekstrak etanol jamur portabella (agaricus brunnescens peck) terhadap bakteri staphylococcus aureus atcc 25923 dan escherichia coli atcc 38218 - USD Repository
Teks penuh
Gambar




Dokumen terkait
Penelitian ini bertujuan mengetahui konsentrasi optimum senyawa alelopati alang-alang yang diekstrak dengan cendawan pengurai molekul organik ( Trichoderma sp.) yang dapat
Berdasarkan penelitian yang telah dilakukan dapat diambil kesimpulan bahwa penilitian ini telah berhasil mengembangkan implementasi metode jaringan syaraf tiruan resilient
Tiga Serangkai Pustaka Mandiri Surakarta yaitu alur sistem pengeluaran barang yang digunakan belum sepenuhnya terdokumentasi dengan baik, Sehingga perlu adanya
Dari tabel di halaman 67 dapat diketahui bahwa siklus waktu hijau dilapangan dan waktu hijau pada perhitungan yang mengacu pada MKJI 1997, dengan hal tersebut
Hasil penelitian menunjukkan bahwa penggunaan lagu dapat meningkatkan kemampuan berbahasa lisan anak kelompok B TK Pertiwi Sidoharjo Sragen Tahun 2011/2012.
Tujuan penelitian ini adalah untuk mengetahui perbedaan motivasi berprestasi antara karyawan etnis Batak dan karyawan etnis Jawa pada PT Kievit Indonesia Kota
Gery Riyandi, 2016, Aplikasi Web Analisis Kinerja Simpang Bersinyal dengan Metode MKJI 1997, Skripsi, Program Studi Teknik Sipil, Fakultas Teknik, Universitas
“ Pemerintah memberikan perlakuan yang sama kepada semua penanam modal yang berasal dari negara manapun yang melakukan kegiatan penanaman modal di Indonesia sesuai