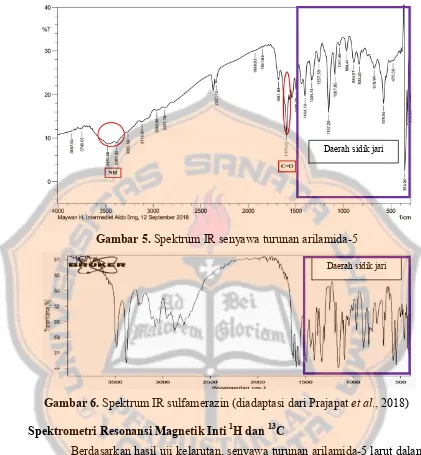
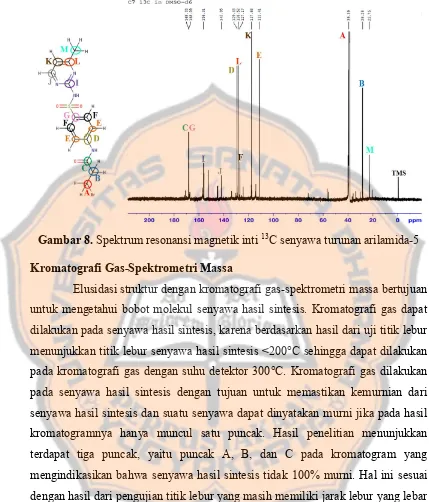
Sintesis turunan arilamida-5 dan uji aktivitas in vitro terhadap enzim matrix metalloproteinase-9 (MMP-9) sebagai kandidat anti-kanker payudara - USD Repository
Bebas
46
0
0
Teks penuh
Gambar


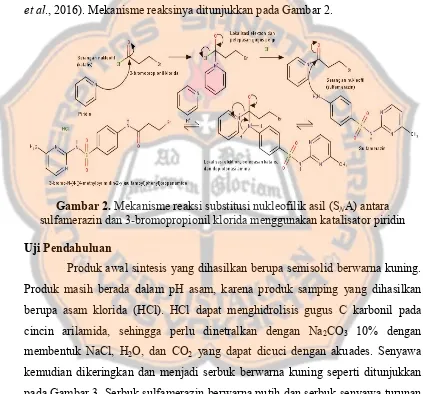

+7
Dokumen terkait