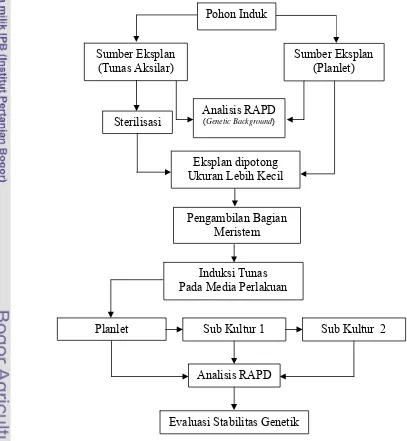
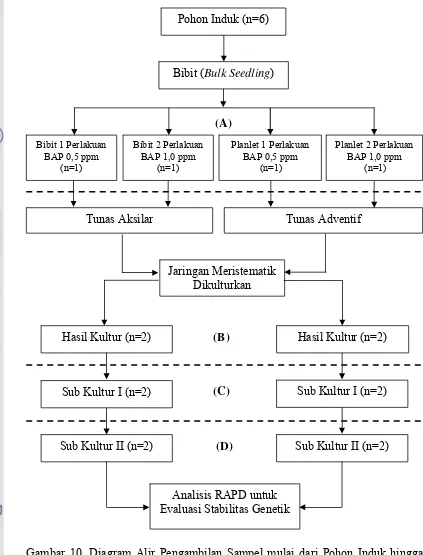
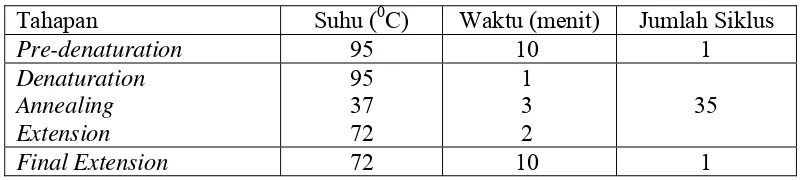
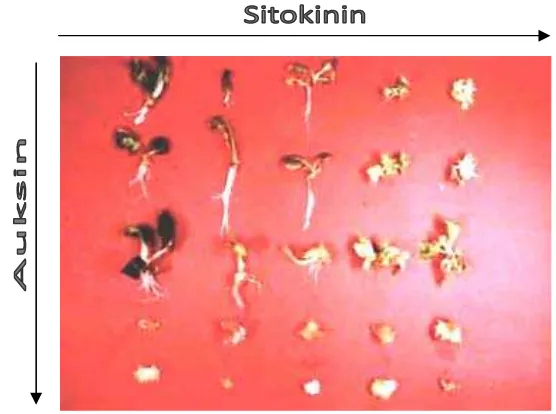
Evaluasi Stabilitas Genetik Tanaman Gaharu (Aquilaria malaccensis Lamk.) Hasil Kultur In Vitro
Teks penuh
Gambar

Dokumen terkait
Lokasi Trans Studio Padang mungkin akan membuat pengunjung yang melewati kota Padang, baik yang dari arah Utara Sumatera seperti Medan maupun arah Selatan
Deskripsi Singkat : Mata kuliah ini memperkenalkan kemampuan wawancara secara umum dan berbasis tingkah laku sehingga mahasiswa memiliki kemampuan dasar dalam menyusun
[r]
informasi yang diberikan Jawaban panjang dan bertele- tele sulit untuk direkam dan diproses. Informasi sukarela yang mungkin tidak terpikirkan oleh si pewawancara untuk
Sehubungan dengan pelaksanaan Evaluasi Administrasi, Teknis, Harga dan Kualifikasi untuk Pekerjaan Pembangunan RKB MI N Simullu Kab..
5.1.1 Proses Menuju Mobil Pemadam dan Menggunakan Alat Pelindung Diri Pekerjaan petugas pemadam yang dituntut harus cepat sampai di lokasi kebakaran untuk memadamkan api
Hal tersebut menunjukkan bahwa potensi pertumbuhan tunas pada bibit okulasi dini menggunakan mata tunas cabang primer dari tanaman entres usia muda jauh lebih
[r]