STRUCTURE ANTIOXIDANT ACTIVITIES RELAT (25)
Teks penuh
Gambar
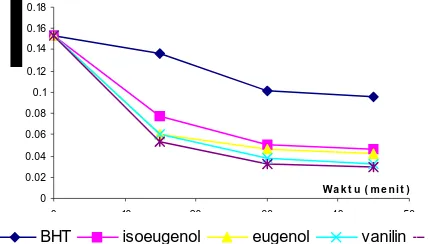
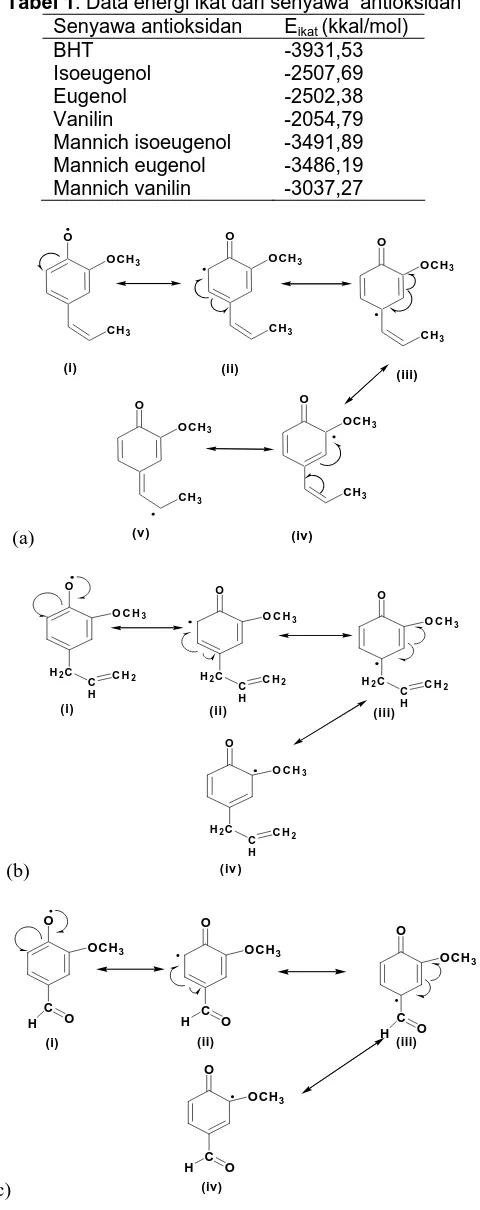
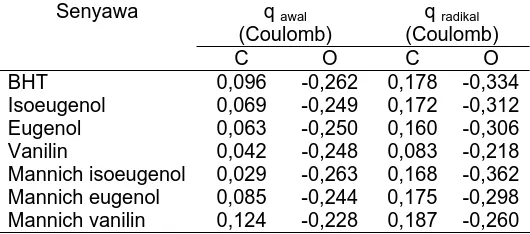
Dokumen terkait
Selanjutnya untuk melihat interprestasi terhadap angka indeks korelasi product moment secara sederhada dapat dilihat pada tabel 4.7 yang berada pada koefisien korelasi
Dukungan paling tinggi dari perokok dan bukan perokok adalah pada kebijakan larangan penjualan rokok pada anak- anak, penyadaran masyarakat terhadap bahaya merokok
Bogdan dan Guba dalam Pratistya, 2015 menyatakan bahwa penelitian kualitatif adalah “prosedur penelitian yang menghasilkan data deksriptif berupa kata-kata tertulis atau lisan
Nilai ini memiliki arti bahwa variasi dari perubahan faktor produksi (modal, tenaga kerja, teknologi), sosial demografi (pengalaman, umur, jumlah anggota rumah
Ketahanan pangan (food security) merupakan kondisi tersedianya pangan dalam jumlah dan kualitas yang cukup untuk kebutuhan masyarakat yang dapat diakses dengan
Rumah tangga di Kutai Kartanegara pada tahun 2015 terkategori sebagai berikut: 48,59 persen adalah rumaht angga tahan pangan yaitu rumah tangga yang memiliki kemampuan
Dari apa yang diuraikan di atas, maka yang menjadi masalah pokok pada tulisan ini adalah: Apakah daya dukung wilayah berpotensi untuk pengembangan industri hilir berbasis kelapa