sma10kim MudahDanAktif Yayan
Teks penuh
Gambar

Garis besar
Dokumen terkait
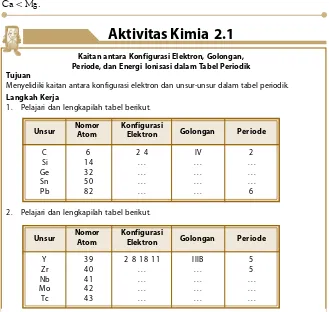
Hubungan Sistem Konfigurasi Elektron dengan Letak Unsur dalam Tabel Periodik Unsur Sifat-Sifat Unsur dan Massa Atom Relatif (Ar) Sifat Keperiodikan Unsur.
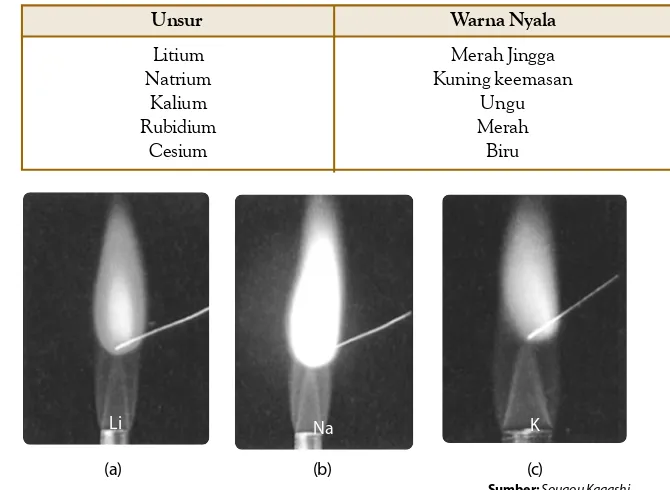
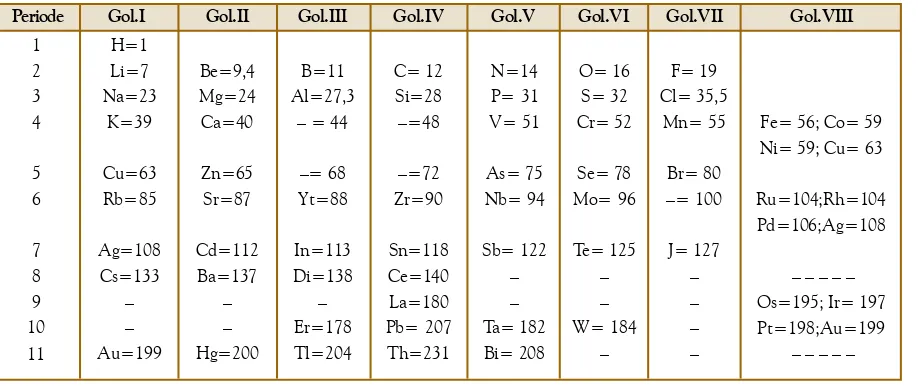
Pengelompokan unsur-unsur dalam sistem periodik modern menghasilkan golongan yang memuat unsur-unsur dengan sifat yang mirip, serta periode di mana terjadi pengulangan
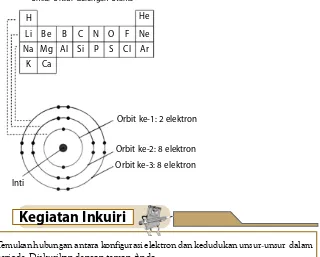
DI UNDUH DARI PRIMALANGGA.BLOGSPOT.COM WINDOWS USER Dari konfigurasi elektron dua golongan unsur di atas, dapat dilihat hubungan antara konfigurasi elektron dengan letak unsur
Unsur-unsur pada periode yang sama memiliki jumlah kulit elektron yang sama; dengan masing-masing perpotongan golongan di sepanjang periode, unsur memiliki satu tambahan
Unsur dalam kelompok A memiliki konfigurasi elektron dan sifat kimia yang sama, kelompok B terdiri dari unsur transisi yang mengandung satu atau dua elektron dalam orbital s
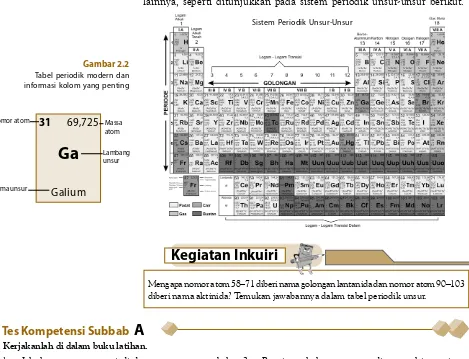
Periode dari suatu unsur sama dengan jumlah kulit yang ditempati oleh elektron atom-atomnya, sedangkan golongan menyatakan elektron valensi dari atom- atomnya. Tabel
ke kanan makin kecil.. Dalam satu golongan, konfigurasi unsur-unsur satu golongan mempunyai jumla elektron valensi sama dan jumlah kulit bertambah. Akibatnya, jarak elektron
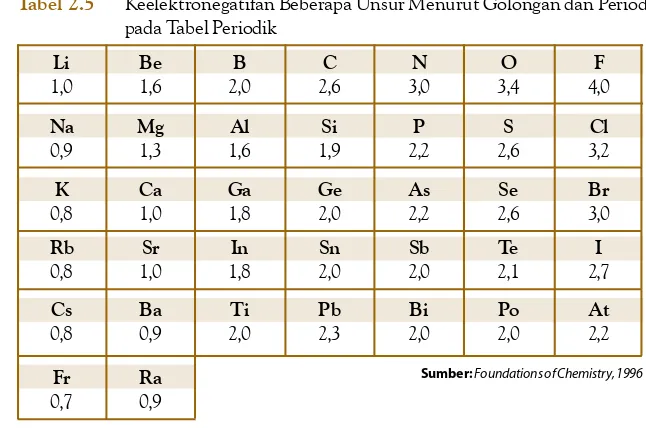
Menganalisis sifat keperiodikan unsur dalam satu golongan dan satu periode yang meliputi sifat jari-jari atom, afinitas elektron, energi ionisasi dan keelektronegatifan. 4.4 Menalar