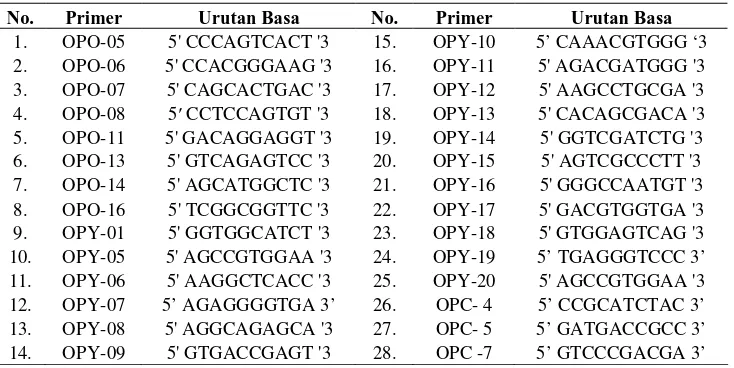
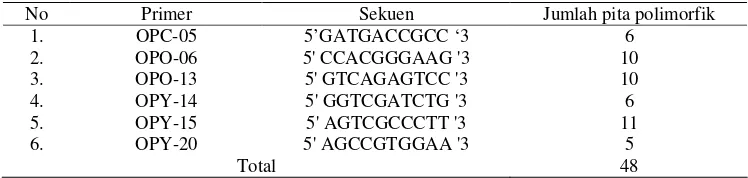
Variasi Genetik dan Teknik Perbanyakan Vegetatif Cemara Sumatra (Taxus sumatrana)
Teks penuh
Gambar

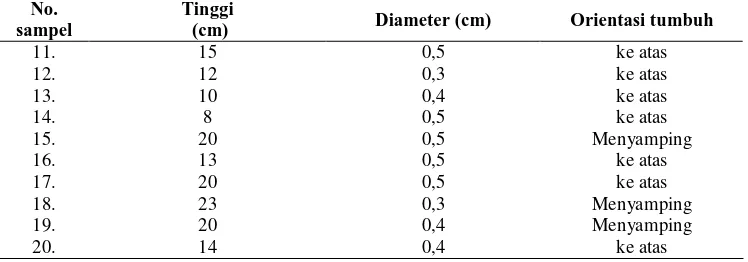

Dokumen terkait
Sebagai salah satu pemain dalam industri elektronik, PT. Max Top juga menghadapi beberapa pesaing potensial yang bermaksud akan mengikuti inovasi yang dilakukan
Alam memberikan segala yang manusia butuhkan dan manusia tinggal memetik hasilnya, sebagai timbale baliknya, manusia harus merawat alam, merawat lingkungan agar
Kita tidak memikirkan tentang teks seperti Roma 2:16 yang mengatakan bahwa “Allah akan menghakimi segala sesuatu yang tersembunyi dalam hati manusia, oleh Kristus
Sedangkan siswa yang mempunyai kreativitas tinggi dengan gaya belajar visual menggunakan media 3D memberikan rerata prestasi lebih tinggi dibanding yang mempunyai gaya
Penelitian ini dilakukan untuk mengetahui pengaruh penggunaan sarana pendidikan terhadap efektivitas proses pembelajaran pada mahasiswa S1 Program Studi Pendidikan
Mahasiswa setelah melaksanakan PPL 2 di SD Negeri Sampangan 02 memperoleh nilai tambah baik itu secara akademik maupun non akademik, nilai tambah itu antara lain :Mahasiswa
Program Praktik Pengalaman Lapangan (PPL) adalah program pendidikan yang diselenggarakan untuk mempersiapkan lulusan S1 kependidikan agar menguasai kompetensi guru
1. Analisis Tujuan dan Masalah Analisis ini dilakukan dengan mendeskripsikan permasalahan yang dihadapi berdasarkan tujuan pengembangan SI yang menjadi obyek