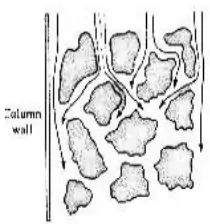
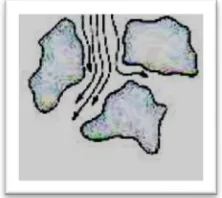
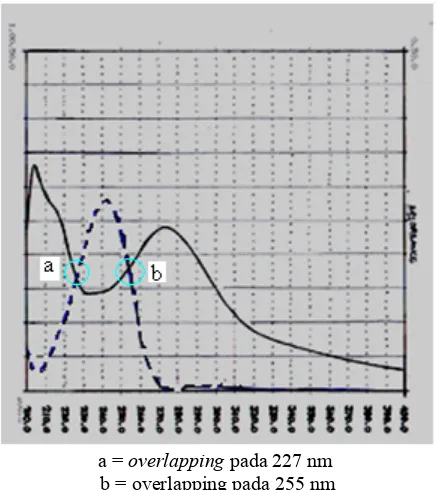
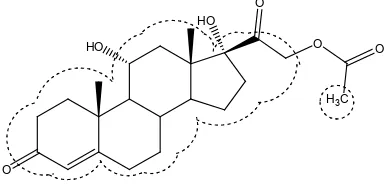
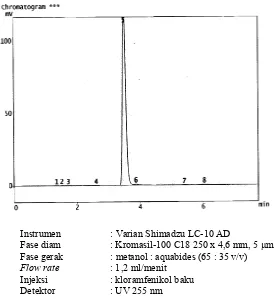
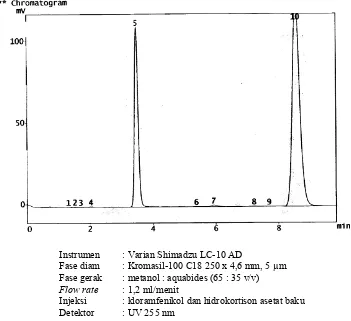
Optimasi pemisahan campuran hidrokortison asetat dan kloramfenikol dalam krim merek X menggunakan metode kromatografi cair kinerja tinggi fase terbalik - USD Repository
Teks penuh
Gambar

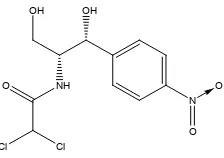
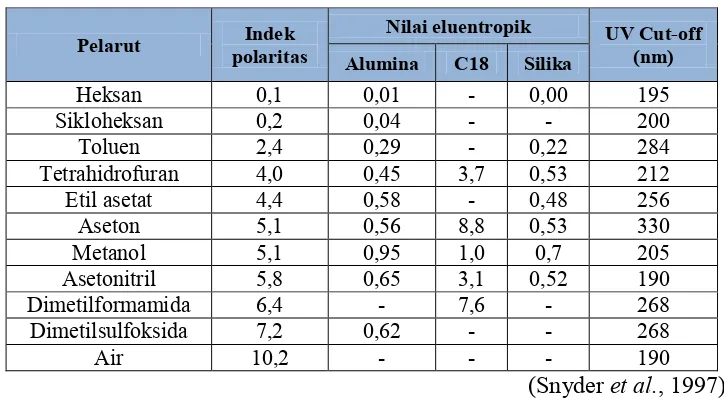
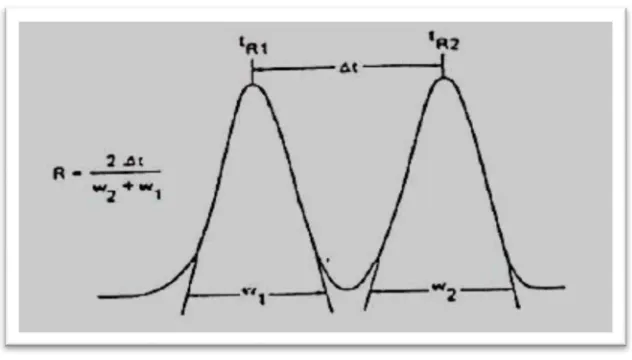
Dokumen terkait
Bahwa Undang-Undang yang dimohonkan untuk diuji terhadap UUD 1945 adalah Undang-Undang Nomor 13 Tahun 2003 tentang Ketenagakerjaan, Pasal 59 yang mengatur tentang Perjanjian
Tujuan dalam penelitian ini adalah untuk (1) Mengetahui berbagai jenis kegiatan Jelajah Alam yang menjadi tren di kalangan mahasiswa Unnes, (2) Mengetahui peran Media
Konseptual Akuntansi Pemerintahan sebagaimana dimaksud pada ayat (2) adalah sebagaimana tercantum dalam Lampiran II yang tidak terpisahkan dari Peraturan Pemerintah ini...
Kabupaten/Kota Sehat adalah suatu kondisi kabupaten/kota yang bersih, nyaman, aman dan sehat untuk dihuni penduduk, yang dicapai melalui terselenggaranya penerapan
dimaksud pada huruf a dan huruf b, perlu menetapkan Peraturan Menteri Lingkungan Hidup dan Kehutanan tentang Perubahan atas Peraturan Menteri Lingkungan Hidup dan
Kegiatan proses produksi yang telah dilakukan oleh peserta didik, mereka dapat mengembangkan kompetensi diri sekaligus kepedulian terhadap masalah lingkungan khususnya
Surat Pemberitahuan Pajak Daerah, yang selanjutnya disebut SPTPD, adalah surat yang oleh Wajib Pajak digunakan untuk melaporkan perhitungan dan/atau pembayaran
Menimbang : bahwa guna menunjang kelancaran pelaksanaan pembangunan dipandang perlu mengubah susunan organisasi Departemen Keuangan dan Departemen Sosial sebagaimana