Efek hepatoprotektif ekstrak metanol:air (50:50) daun macaranga tanarius L. terhadap kadar ALT-AST serum pada tikus terinduksi karbon tetraklorida - USD Repository
Teks penuh
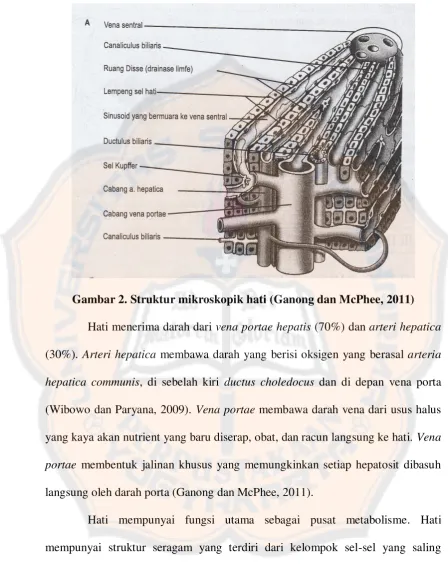
Gambar


Dokumen terkait
[r]
Maka, perlu disiapkan sumber daya yang berkualitas dan unggul untuk memenuhi kebutuhan yang meningkat untuk produktivitas yang lebih baik dan tanggung jawab sosial yang tinggi..
“Sebenarnya cara untuk membentuk dan mengembangkan kepribadian santri baik di dalam atau di luar kelas itu sama saja.. Mau tidak mau ya harus dipaksa terlebih dahulu, yang
Variabel kondisi selokan, dari hasil analisis menunjukkan terdapat hubungan antara kondisi selokan yang buruk dengan kejadian leptospirosis di Kabupaten Pati ( p =
Baku emas pemeriksaan tersebut adalah spektrofotometer , tetapi penggunaan glukometer lebih sederhana , oleh karena itu, tujuan penelitian ini untuk mengetahui
Selama ini perkara yang berasal dari wilayah kabupaten Nunukan ditangani di Pengadilan Agama Tarakan, ada yang disidangkan di Tarakan dan juga ada yang disidangkan dengan cara
Pada pensiunan umum, sebagai sistem dasar pensiunan umum tergantung dari orang yang masuk, “orang yang berusia lanjut, terganggu/cacat dan bantuan untuk keluarga yang
Mengacu dari uraian yang sudah dijelaskan di atas bahwa penerapan model Missouri Mathematics Project (MMP) menggunakan teknik permainan kartu arisan merupakan model