Analisa Laju Korosi pada Pipa Baja Karbon dan Pipa Galvanis dengan Metode Elektrokimia - ITS Repository
Teks penuh
Gambar


Dokumen terkait
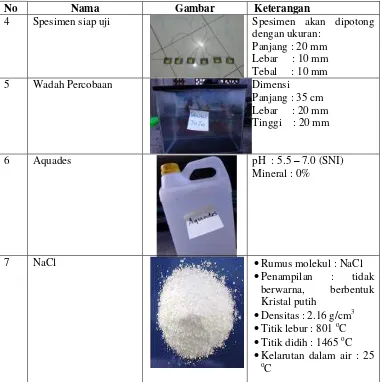
Dari hasil uji weightloss dapat dilihat laju korosi yang terjadi pada spesimen baja karbon yang dilakukan proses coating dan non-coating setelah dilakukan pengujian selama
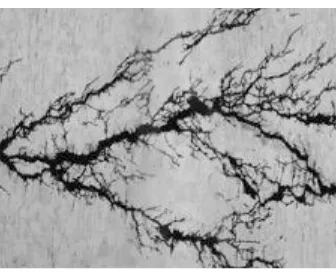
Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2007 ini ialah Kerentanan Korosi Batas Butir Baja Tahan Karat Tipe 316 Dengan
Penelitian telah dilakukan untuk mengetahui laju korosi yang disebabkan oleh tiga media korosi yaitu air hujan, air laut dan asam sulfat terhadap logam- logam
Hasil pengujian laju korosi yang dilakukan dengan waktu 1 jam, didapat nilai rata-rata untuk spesimen I pada baja karbon dan paduan tembaga dalam larutan air laut adalah 0,105
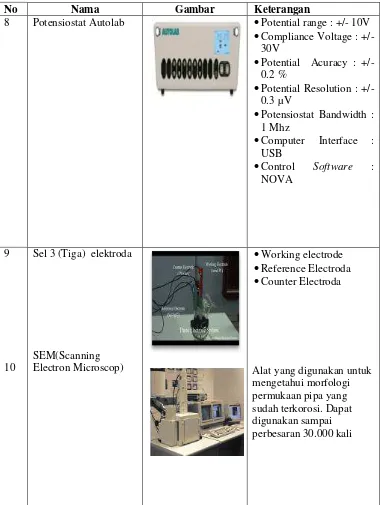
Teknik monitoring korosi dapat dibagi menjadi beberapa metode yaitu kinetika ( weight loss ) dan elektrokimia (diagram polarisasi, linear polarization resistance ,
Metode polarisasi merupakan salah satu metode pengujian yang banyak digunakan untuk menentukan laju reaksi atau kinetika reaksi korosi yang terjadi pada logam.. Beberapa
Korosi merupakan reaksi elektrokimia antara logam dan lingkungan yang menyebabkan karat dan menurunkan mutu logam, tujuan dari penelitian ini untuk menganalisa terjadinya
Berdasarkan gambar 3 diperoleh perbedaan laju korosi antara laju korosi dari model dengan laju korosi hasil percobaan yang relatif kecil sekitar 1,5 %, hal ini