Sintesis 4-[(4ˈ-hidroksi-3ˈ-metoksibenzilidena)-amino]-benzensulfonamida dari sulfanilamida dan vanilin dengan katalis asam sulfat pada pH 4-5 - USD Repository
Teks penuh
Gambar



Dokumen terkait
2006 Instruktur Dalam Kegiatan Praktikum Fisika Lanjut bagi mahasiswa Program Pendidikan Fisika Jurusan Tadris Universitas Islam Negeri Sunan Gunung Jati Bandung. FPMIPA UPI
Tertutup adalah tempat atau ruang yang ditutup oleh atap dan/atau dibatasi oleh satu dinding atau lebih, terlepas dari material yang digunakan dan struktur
Pun dan paronomasia adalah kiasan dengan mempergunakan kemiripan bunyi. Ia merupakan permainan kata yang didasarkan pada kemiripan bunyi, tetapi terdapat
Target juga disesuaikan dengan hasil baseline yang didapatkan dan tidak terlalu terpaku pada standar kriteria penilaian fidelity of implementation dari Koegel
Berdasarkan hal tersebut, penulis mencoba menerapkan activity-based costing untuk menghitung kos dari kedua proses tersebut sesuai dengan aktivitas yang dilakukannya dan
Ketua Umum dan Sekretaris Umum melantik Pengurus Daerah dan Pengurus Cabang yang mekanisme pemilihan dan pengangkatan serta hal- hal yang berkaitan dengan keberadaan
Bagi peserta calon pegawai tugas belajar yang dinyatakan Memenuhi Syarat (MS), akan diberikan pengarahan/pembekalan oleh Badan Pendidikan dan Pelatihan Provinsi DKI
Berdasarkan hasil penelitian di kawasan Giribangun Girilayu, Matesih, Karanganyar , Jawa Tengah ,diperoleh 8 jenis tumbuhan lichenes, tipe morfologi thallus yang ditemukan


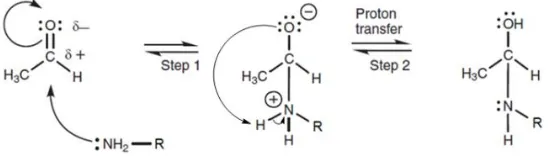


![Gambar 10. Mekanisme reaksi pembentukan senyawa 4-[(4 ˈ-hidroksi-3ˈ-metoksibenzilidena)-amino]-benzensulfonamida](https://thumb-ap.123doks.com/thumbv2/123dok/1807024.2099395/47.595.104.496.108.701/gambar-mekanisme-reaksi-pembentukan-senyawa-hidroksi-metoksibenzilidena-benzensulfonamida.webp)