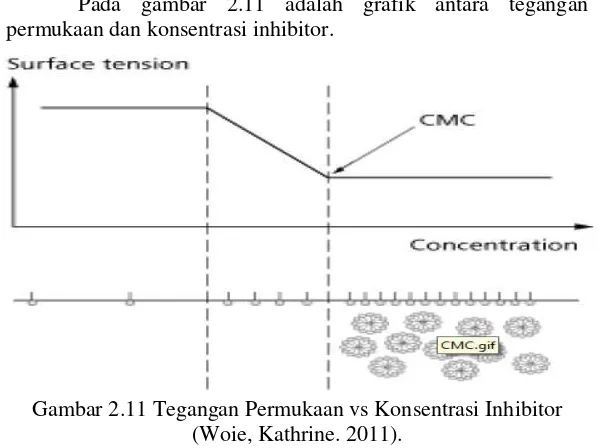
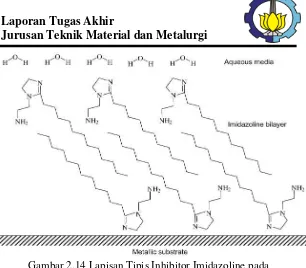
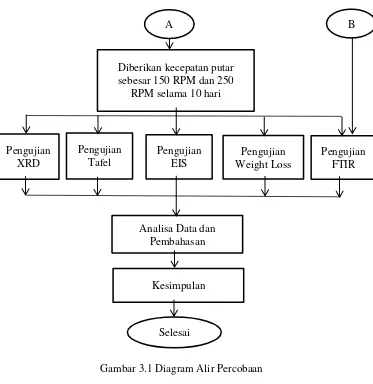
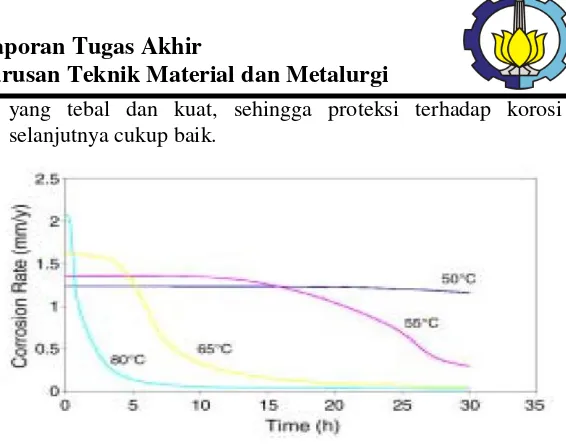
PENGARUH pH, KECEPATAN PUTAR DAN KONSENTRASI INHIBITOR BERBASIS IMIDAZOLINE TERHADAP LAJU KOROSI BAJA AISI 1045 DI LINGKUNGAN YANG MENGANDUNG GAS CO2
Teks penuh
Gambar

Dokumen terkait
sumber fosfat anorganik dan unsur-unsur pelengkap lainnya menyebabkan koloni bakteri yang tumbuh merupakan koloni bakteri pelarut fosfat yang mampu memanfaatkan
"Dari segala kutipan ini jelaslah kiranya bahwa gambaran Hamzah tentang Allah tidak sa- ma dengan gambaran Al-Qur'an." Sebab oleh Hamzah Fansuri Dzat yang Mutlak
(2) Tingkatperputaran kredit sebagai variabel moderasi berpengaruh negatif dan signifikan terhadap pertumbuhan kredit dan profitabilitas dengan nilai negatif 0,111 dengan
Oleh karena itu penulis melakukan penelitian dengan judul “Pengaruh Dewan Komisaris Independen, Komite Audit, Kepemilikan Institusional dan Kepemilikan Asing terhadap Pengungkapan
Abstrak: Materi pertidaksamaan kuadrat mempunyai peran penting dalam matematika karena termasuk dalam salah satu hal pokok yang menjadi bidang kajian utama dalam
“Necdet Özel şu anda Kara Kuvvetleri Komutanı olursa, Genelkurmay Başkanlığı yolu kapanmış olur, Genelkurmay Başkanı’nın üç senesi daha var, Necdet Özel şimdi
Secara menyeluruh tujuan dan tampilan esensinya mencakup kebutuhan teknis dan proses, yang akan digunakan untuk merancang fasilitas penyimpanan limbah radioaktif dekat
Pengguna menjalankan perangkat lunak pada Google Glass Pengguna mengakses modul data pasien pada panel menu Pengguna mengambil citra wajah pasien menggunakan kamera dan