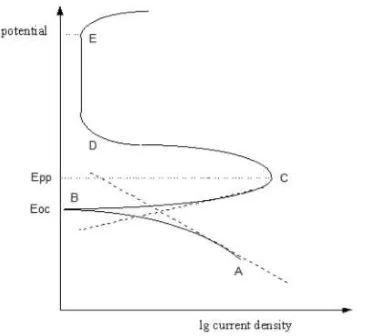
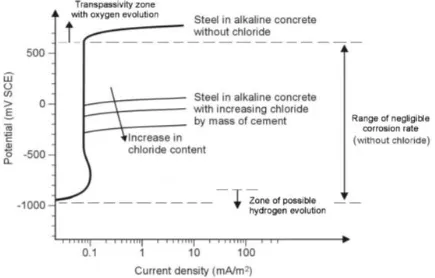
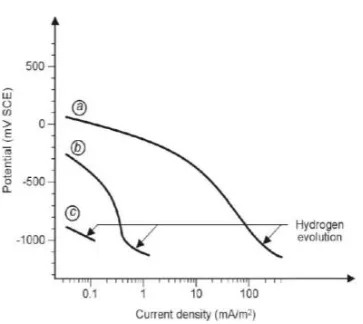
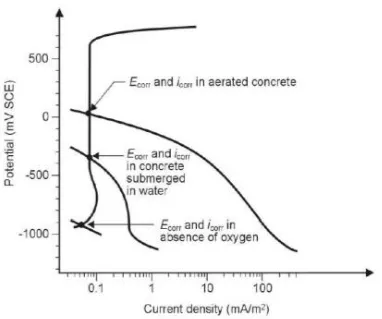
ALAMAN JUDUL - Analisa Perencanaan Proteksi Katodik Pada Kaki Dermaga Teluk Lamong - ITS Repository
Teks penuh
Gambar
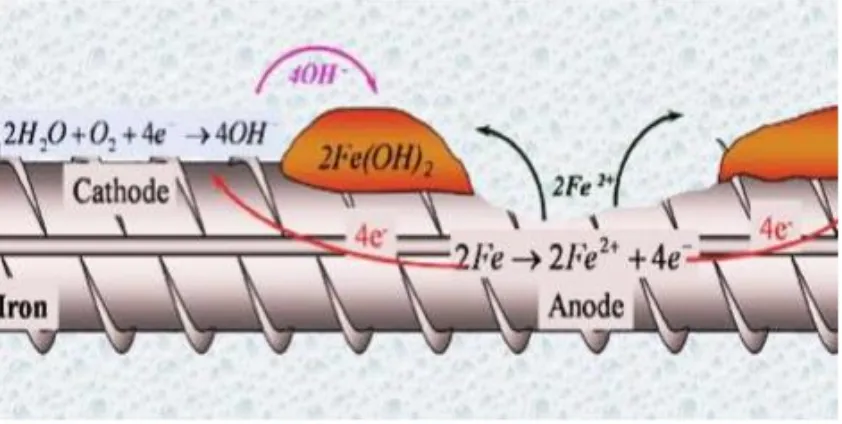
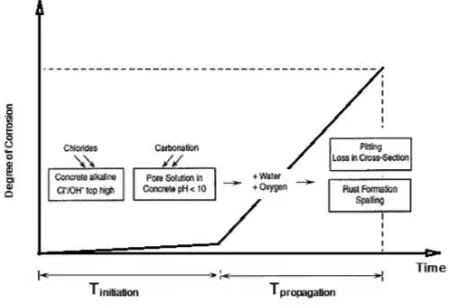
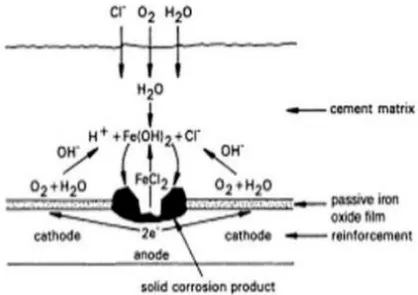
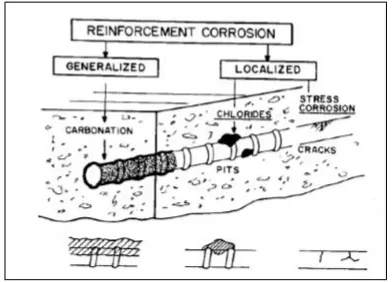
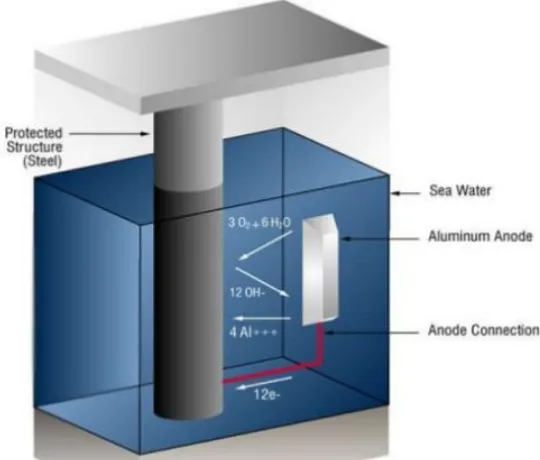
Dokumen terkait
selaku dosen pembimbing yang telah mendampingi, memberikan saran, dan membantu menyelesaikan masalah yang dihadapi penulis selama penulisan karya tulis ini. Hiroaki Chijiiwa Sensei
Hasil penelitian yang telah dilakukan menunjukkan bahwa terdapat perbedaan bermakna nilai daya ledak otot tungkai antar dua cabang olahraga, yaitu bola voli dan
Jadwal Pembimbingan Akademik Program Studi Teknik Industri UAJY untuk Kegiatan Pembimbingan Pengisian KRS Semester
Nama Nama NIM NIM Program Studi Program Studi Mata Kuliah Mata Kuliah
Basis perhitungan pada perancangan ini adalah laju alir air pendingin 431 liter/jam dengan suhu air pedingin keluar 42 OC dan suhu air masuk 40 OC Tangki simulasi teras reaktor
Teknik analisis data yang digunakan adalah menganalisis input sistem informasi akuntansi, yaitu dokumen dan formulir yang digunakan dalam pengadaan dan pengelolaan
memberi acuan agar peserta didik dapat melakukan pengecekan hasil eksplorasi; memberi informasi untuk bereksplorasi lebih jauh; memberikan motivasi kepada peserta didik yang
analisis dilakukan secara induktif, kesimpulannya bahwa Kepala Sekolah Sebagai Supervisor pengajaran berarti Kepala Sekolah mendorong kemampuan guru membimbing siswa