Laporan Penentuan Tiik Beku Larutan
Teks penuh
Gambar

Garis besar
Dokumen terkait
Tujuan : Mengamati titik didih zat pelarut (air) dan pengaruh zat terlarut pada titik didih larutan, serta menentukan nilai kenaikan titik
4. Titik beku larutan merupakan sifat koligatif dan di pengaruhi oleh jumlah partikel dan konsentrasi. Semakin besar konsentrasi konsentrasi zat terlarut dalam
Penurunan titik beku yang diakibatkan oleh satu mol partikel zat terlarut dalam satu kilogram pelarut disebut penurunan titik beku molal, yang digunakan sebagai tetapan untuk
Berdasarkan zat wujud terlarut dan zat pelarut, larutan dapat dibagi dalam tujuh macam. Dari tiga jenis wujud zat seharusnya terbentuk sembilan macam zat larutan, tetapi zat
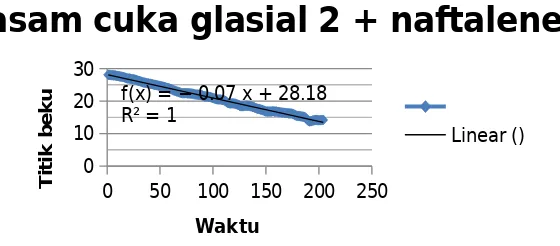
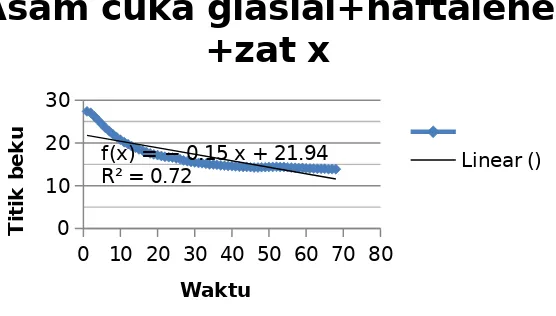
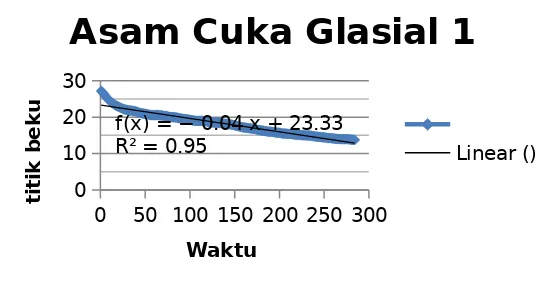
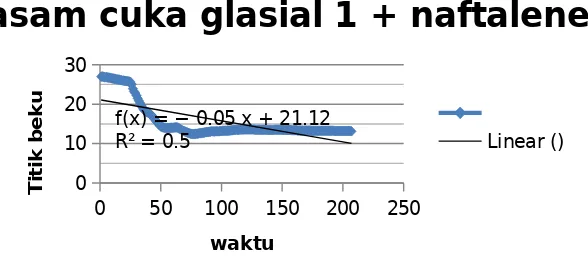
Harga Kf yang diperoleh dari percobaan pertama, yaitu penurunan titik beku asam asetat pada penambahan zat terlarut yang telah diketahui secara pasti berat
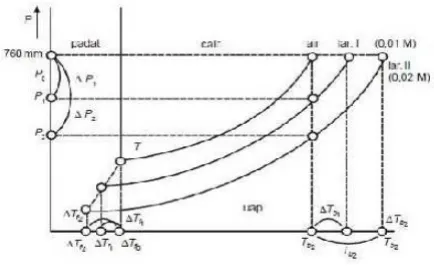
Bila kedalam suatu cairan dilarutkan zat lain, maka potensial kimia dalam pelarut lebih rendah dari potensial kimia pelarut murni yang menyebabkan penurunan titik
Suatu larutan dengan tekanan uap yang lebih rendah dari zat pelarut murni tidak akan seimbang dengan zat pelarut yang padat pada titik beku normalnya.. Sistem tersebut
SIFAT KOLIGATIF LARUTAN • Kenaikan titik didih larutan Jika suatu zat terlarut tidak mudah menguap ditambahkan ke dalam suatu pelarut, titik didihnya meningkat Sifat larutan yang