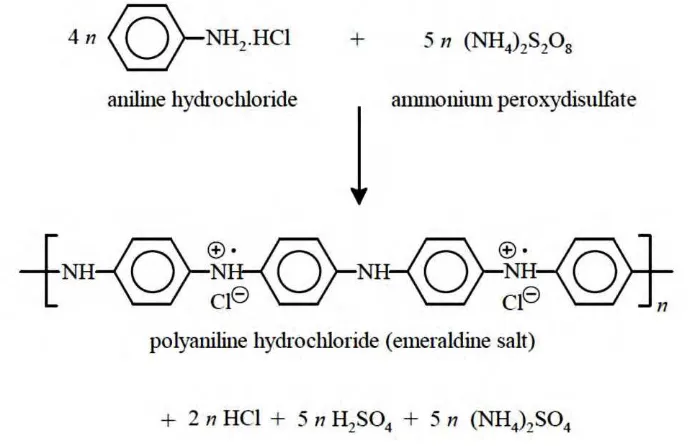
KETAHANAN KOROSI LAPISAN KOMPOSIT PANICaCO3 DALAM LINGKUNGAN GEOTERMAL
Teks penuh
Gambar
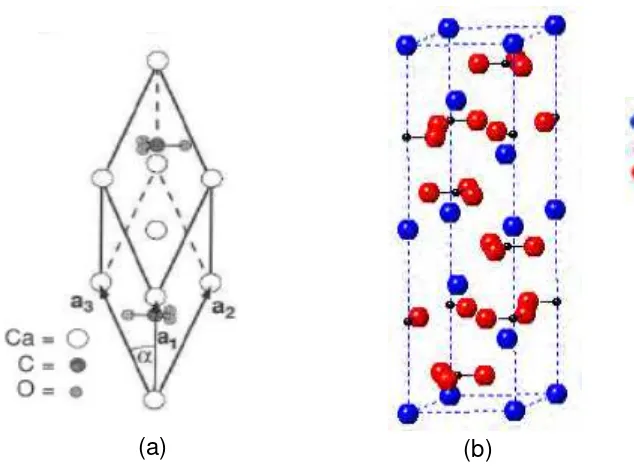
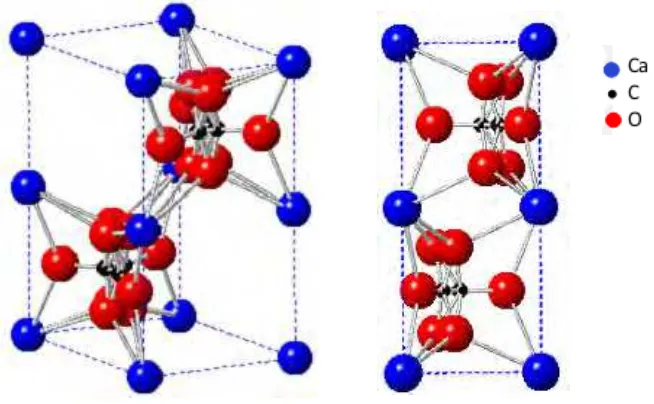
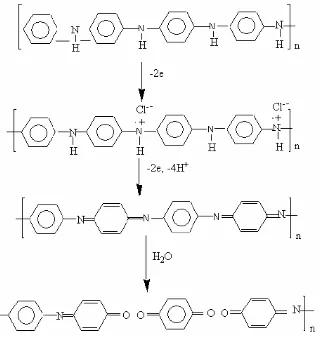

Dokumen terkait
Objektif utama kajian ini adalah untuk mendapatkan gambaran tentang: (1) permasalahan dan keperluan warga tua untuk meningkatkan tahap berdikari mereka; (2) program
DAPATAN DAN PERBINCANGAN KAJIAN Pengenalan Latar Belakang Sampel Kajian Profil Demografi Responden Skor Min Orientasi Kerjaya Protean, Kesepadanan Individu-Pekerjaan, Mentoran
Peserta didik diarahkan guru untuk cara membaca ayat dan hadis dengan benar tentang Syukur Nikmat Allah untuk menyelesaikan permasalahan yang ada di dalam materi tersebut
Jika model data SPPD yang dipilih adalah berasaskan model hubungan, semua objek dalam model data konseptual akan ditukar kepada bentuk jadual yang terdiri daripada lajur dan baris..
Kirom, Syahrul, 2011, Ajaran Moral Masyarakat Samin dalam Perspektif Etika: Relevansinya bagi Pengembangan Karakter Bangsa, Tesis: tidak diterbitkan, Program Master
lni tidak berarti meninggikan penatua tersebut diatas penatua-penatua yang lainnya melainkan Tuhan Yesus menempatkan orang tersebut didalam tanggung jawab sebagai yang pertama
Kairing puji syukur konjuk dhumateng Gusti Ingkang Murbeng Dumadi, ing wekdal punika kita sedaya saged hangestreni adicara Kagiatan Eva- luasi Lan Penajaman Palaksanan
Produk songket diciptakan dengan bentuk dan kontruksi yang terstruktur, disesuaikan dengan ketentuan yang berlaku.Perkembangan songket dari Kampoeng Tenun Indralaya masih