Daya antibakteri ekstrak etanol, fraksi etil asetat, dan perasan daun lidah mertua (sansevieria trifasciata prain) terhadap bakteri staphylococcus aureus atcc 25923 dan pseudomonas aeruginosa atcc 27853 - USD Repository
Teks penuh
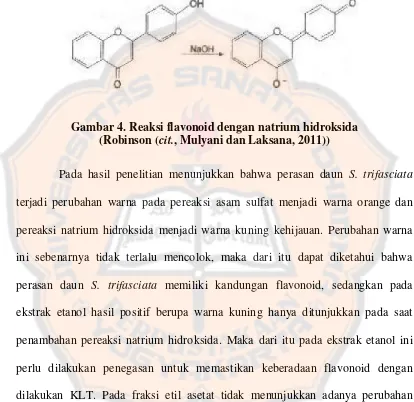
Gambar




Dokumen terkait
PENGARUH VOLUME FRAKSI SERAT TERHADAP SIFAT MEKANIK KOMPOSIT POLYPROPYLENE SERAT. LIDAH MERTUA
Menyatakan dengan sesungguhnya bahwa karya ilmiah yang berjudul “ Uji Konsentrasi Ekstrak Daun Mindi (Melia azedarch L) dan Lidah Mertua (Sansevieria trifasciata
Berdasarkan hasil penelitian, diketahui maserasi 4 hari dan sokletasi 2 kali penyarian menghasilkan ekstrak etanol daun lidah mertua dengan aktivitas antibakteri optimum
Hasil uji toksisitas menunjukkan bahwa mencit yang diberikan ekstrak etanol daun lidah mertua pada kelompok kontrol dan kelompok perlakuan dengan dosis 250, 500, dan 1000 mg/kg
apakahada perbedaan antara ekstrak etanol daun lidah mertua dengan glibenklamid dalam memberikan efek penurunan kadar glukosa darah mencit yang diberi loading dose glukosa..
PENGARUH PEMBERIAN EKSTRAK DAUN LIDAH MERTUA (Sansevieria trifasciata var. laurentii) TERHADAP KADAR TIMBAL DARAH PADA TIKUS (Rattus norvegicus strain wistar) YANG DIINDUKSI..
Pada penelitian ini digunakan tanaman lidah mertua ( Sansevieria trifasciata Prain) untuk menarik ion logam berat Cu(II) dari tanah dengan variasi waktu sehingga
Penelitian ini memiliki tujuan yaitu untuk menguji aktivitas antibakteri ekstrak lidah mertua Sanseviera trifasciata Prain terhadap bakteri Staphylococcus aureus dan Propionibacterium