Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT), dan identifikasi escherichia coli dalam jamu cekok dari penjual jamu racik ``x`` di Yogyakarta - USD Repository
Teks penuh
Gambar



Dokumen terkait
Parameter yang digunakan untuk uji cemaran mikroba pada kembang gula lunak bukan jelly adalah uji Angka Lempeng Total (ALT) yang diamati selama 2 hari, uji Angka Kapang Khamir
Mutu dan keamanan jamu serbuk kunyit yang dikonsumsi masyarakat dapat dilihat dari nilai Angka Kapang/Khamir (AKK) dan ada tidaknya bakteri Staphylococcus aureus
Mutu dan keamanan jamu serbuk kunyit yang dikonsumsi masyarakat dapat dilihat dari nilai Angka Kapang/Khamir (AKK) dan ada tidaknya bakteri Staphylococcus aureus
Bahan baku yang digunakan dalam pembuatan jamu uyup-uyup yang diproduksi oleh penjual jamu racik X terdiri dari temulawak ( Curcuma xanthorrhiza Roxb.), kunyit
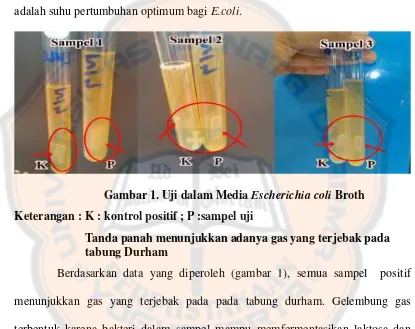
Setelah diinkubasi, pada kontrol positif, sampel 2 (koloni 1 dan 2), dan sampel 3 (koloni 1) menunjukkan hasil positif, ditandai dengan adanya perubahan warna media dari
Keberadaan kapang atau khamir dalam suatu produk jamu atau makanan tidak dapat hilang 100% hanya dapat diminimalkan, dari nilai AKK sampel 16A ( Tujuh Angin) dan sampel 55A
Jenis penelitian ini adalah penelitian non-eksperimental dengan rancangan penelitian deskriptif komparatif, yaitu mendeskripsikan besarnya nilai ALT dan AKK dalam jamu
Jenis penelitian bersifat deskriptif kualitatif dengan metode Angka Lempeng Total (ALT). Hasil penelitian ini berupa gambaran tentang cemaran angka kapang pada produk