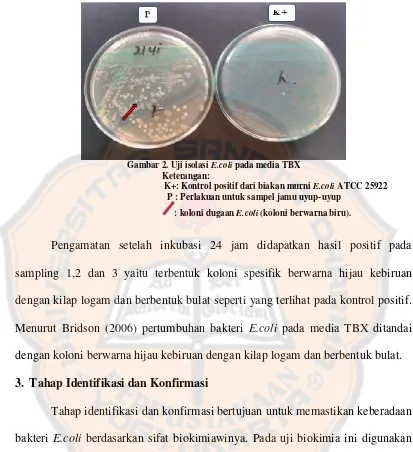
Uji Angka Kapang/Khamir (AKK), Angka Lempeng Total (ALT), dan identifikasi escherichia coli dalam jamu uyup-uyup dari penjual jamu racik ``x`` di Yogyakarta - USD Repository
Teks penuh
Gambar




Dokumen terkait
Menurut saya pengertian dari segitiga sama sisi adalah suatu bidang datar yang dibatasi pleh tiga buah garis lurus” [Lalu mengambil segitiga sama sisi warna pink] “Tiga
Menimbang, bahwa berdasarkan relaas Panggilan untuk Tergugat dimana Jurusita Pengganti Pengadilan Agama Pangkalpinang telah memanggil Tergugat secara resmi dan
Penggunaan PLTMH sebagai energi alternatif yang cost friendly, user friendly, environment friendly, and material friendly diharapkan dengan peran Puslitbang
Dalam melakukan penelitian perlu adanya desain penelitian terlebih dahulu. 6) desain penelitian merupakan rencana untuk memilih sumber-sumber data dan data yang akan dipakai untuk
Teman-teman KLAbers angkatan 2011 ada Kak Nila Anggreiny yang sudah memberikan waktu untuk memperhatikan kami, mengontrol, memberi semangat dan nasihat untuk kebaikan penulis
Penyimpangan yang terjadi antara anggaran biaya operasional dengan realisasi pengeluarannya berdampak pada perolehan laba perusahaan, dimana perolehan laba perusahaan lebih kecil Rp
Berdasarkan penelitian yang telah dilakukan oleh tiga partisipan ditemukan hasil bahwa masing- masing subjek memiliki dinamika psikologis yang berbeda dalam menghadapi
Peringkat 4 : Jumlah, komposisi, integritas dan kompetensi Komisaris kurang sesuai dibandingkan dengan ukuran dan kompleksitas usaha Bank serta pemenuhan terhadap