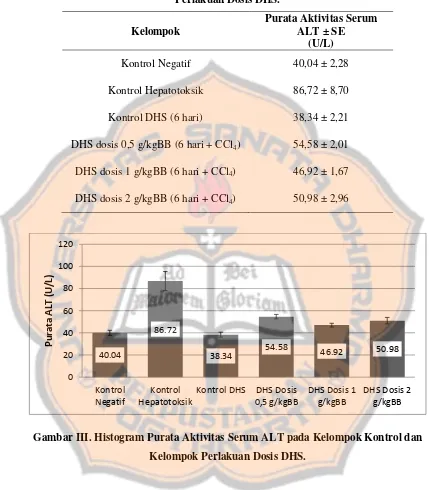
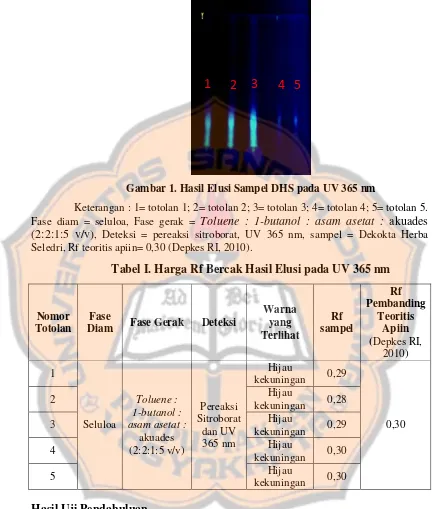
Uji hepatoprotektif dekokta herba seledri terhadap aktivitas serum ALT pada tikus betina galur wistar terinduksi karbon tetraklorida - USD Repository
Teks penuh
Gambar



Dokumen terkait
menggunakn bahan/barang yang ditemukan di lingkungan tempat tinggal siswa. Melihat penjelasan di atas dapat disimpulkan bahwa KIT IPA merupakan alat yang berguna
Dengan menggunakan media audio secara tepat dan bervariasi dapat mengatasi sikap pasif siswa, lingkungan, kenyataan, dan memungkinkan siswa untuk belajar sesuai dengan
Ada pula tesis yang ditulis pada tahun 2007 oleh Rita Susanti, mahasiswa S2 Universitas Indonesia, yang berjudul Tindak Tutur Memohon Dalam Bahasa Jepang dan Faktor Sosial
Pembakaran dan pengembangan gas ini terjadi di dalam ruang bakar yang sempit dan tertutup (tidak bocor) dimana bagian atas dan samping kiri kanan dari ruang bakar adalah
Dend dJsujav SEttr. ENGLISS
Disamping Sari Sejarah Serdang; Jati Diri Melayu juga penulis pakai karena dengan adanya karya ini penulis lebih memahami akan budaya politik Melayu yang
Maka, perlu disiapkan sumber daya yang berkualitas dan unggul untuk memenuhi kebutuhan yang meningkat untuk produktivitas yang lebih baik dan tanggung jawab sosial yang tinggi..
bal$a semburc Rrbar sangar berpore.si sebasai rumbuhar invdjt lnrna hampn scntra cin cni nmbL$6 invasil dinrilikinya, didblnya biji sedbu.g.. rmbll dlpal berkccmbji