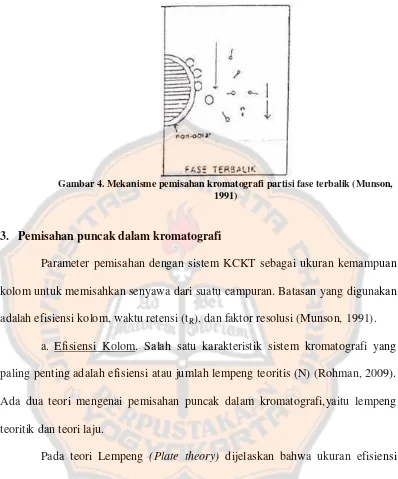
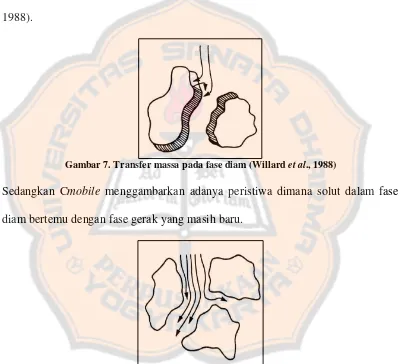
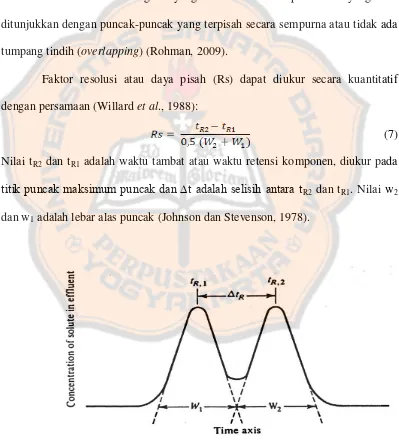
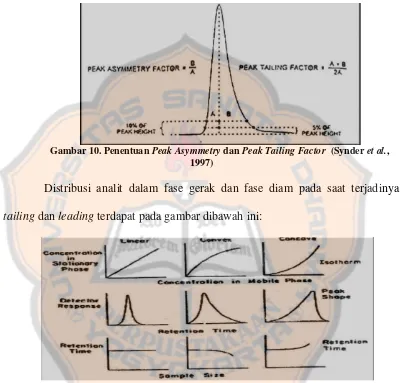
Optimasi metode kromatografi cair kinerja tinggi fase terbalik pada pemisahan kloramfenikol dan lidokain hidroklorida dalam sediaan tetes telinga Colme - USD Repository
Teks penuh
Gambar

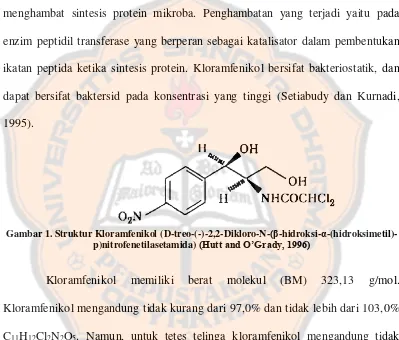
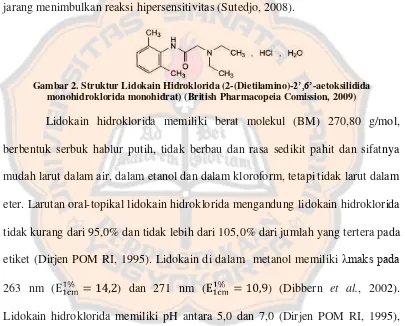

Dokumen terkait
Telah dilakukan penelitian mengenai optimasi komposisi dan kecepatan alir fase gerak sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik pada penetapan kadar
Tujuan penelitian ini adalah untuk mengetahui kondisi optimal fase gerak dari KLT densitometri sehingga dapat menghasilkan pemisahan optimal dan dapat menetapkan
Waktu retensi, nilai tailing factor, dan nilai resolusi baku asam askorbat 100 µ g/mL pada komposisi fase gerak metanol : bufer fosfat 0,01 M pH 3 dengan perbandingan 40 :
Dilakukan pemisahan dengan fase gerak metanol : aquabidest (90:10) pH 4 pada kecepatan alir 1,5 ml/menit terhadap tiga level konsentrasi dengan parasetamol : ibuprofen sebesar 70 ppm
Pada penelitian ini akan dilakukan penetapan kadar campuran kloramfenikol dan lidokain HCl dalam sampel obat tetes telinga Colme ® dengan metode kromatografi
Jenis dan komposisi fase gerak yang optimum yang dapat memberikan bentuk peak yang simetris, sempit, dan tajam; nilai R f berada dalam range 0,2-0,8; nilai resolusi ≥ 1,5; dan nilai
Penelitian yang akan dilakukan adalah optimasi pemisahan campuran baku kloramfenikol dan lidokain HCl sebagai zat aktif di dalam obat tetes telinga Colme ®
Tujuan penelitian ini adalah untuk mengetahui kondisi optimal fase gerak dari KLT densitometri sehingga dapat menghasilkan pemisahan optimal dan dapat menetapkan