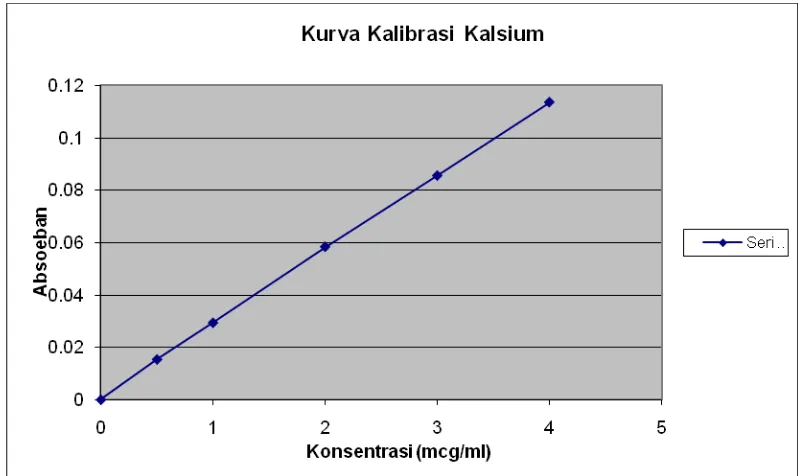
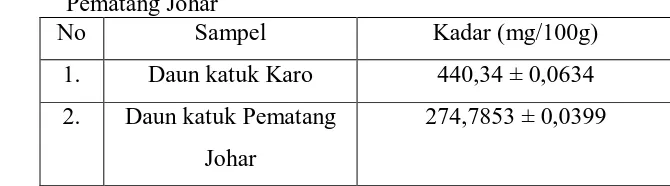
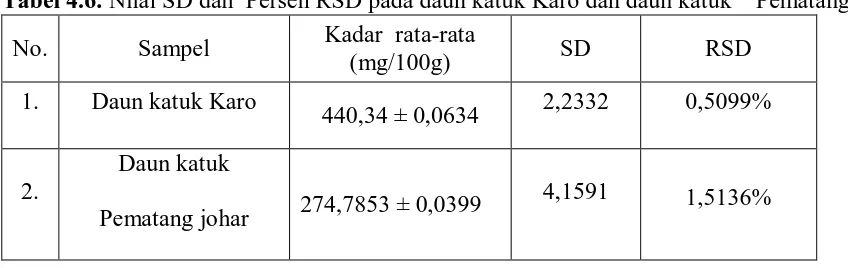
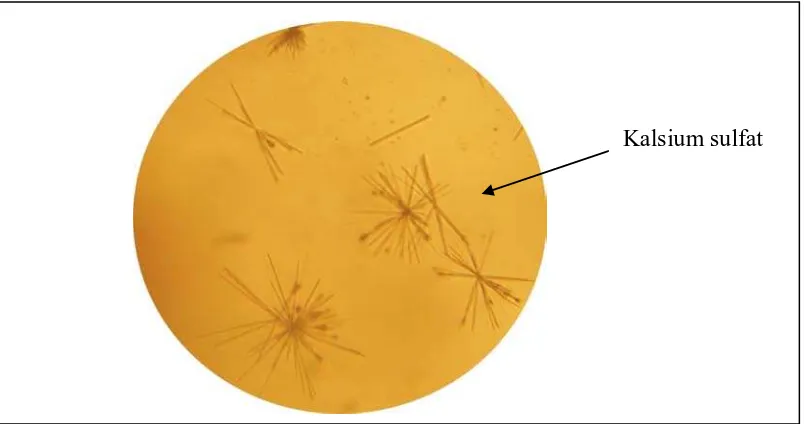
Penetapan Kadar Kalsium pada Daun katuk (Sauropus androgynus (L.) Merr.) dari Daerah Karo dengan Daerah Pematang Johar Secara Spektrofotometri Serapan Atom
Teks penuh
Gambar

Dokumen terkait
nasabah yang datang ke kantor pelayanan. Aspek ini merupakan bagian dari dimensi reliability, yang secara umum dipersepsikan dengan memuaskan oleh responden. Namun indikator
Instrumen yang digunakan dalam penelitian ini adalah terdiri dari; tes kemampuan kreatif matematik, tes pemecahan masalah matematika, lembar observasi, dan
Dari hasil analisis uji pengaruh parsial, terbukti bahwa ada pengaruh yang bermakna (signifikan) antara variabel bebas, yaitu variabel pelatihan yang terdiri atas
Hasil penelitian ini didasarkan pada tujuan penelitian yaitu untuk mengetahui prosedur pemberian tugas berbasis portofolio dalam proses kegiatan belajar mengajar
melakukan kejahatan (anak yang berkonflik dengan hukum). Seringkali hak-hak anak yang melakukan kejahatan atau yang berkonflik dengan hukum tersebut tidak dilindungi
Jika 2 titik letis mempunyai paritas yang sama maka sesuai sifat penjumlahan maka dapat dipastikan kedua titik letis memiliki jarak mendatar dan jarak vertikal merupakan bilangan
Komisi yang diberikan kepada pialang asuransi, agen dan perusahaan asuransi lain sehubungan dengan penutupan pertanggungan dicatat sebagai beban komisi, sedangkan komisi yang
Tujuan umum dari penelitian ini adalah mengetahui hubungan tingkat pengetahuan dan sikap ibu terhadap kepatuhan pemberian imunisasi dasar pada bayi di Desa Mororejo