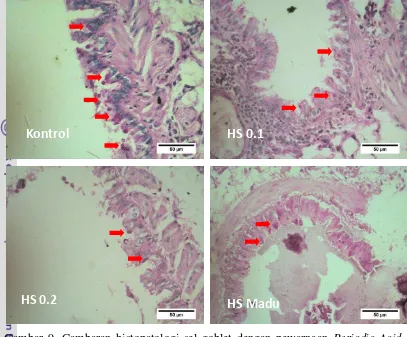
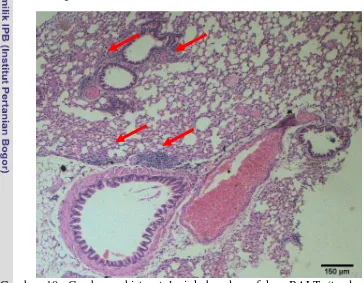
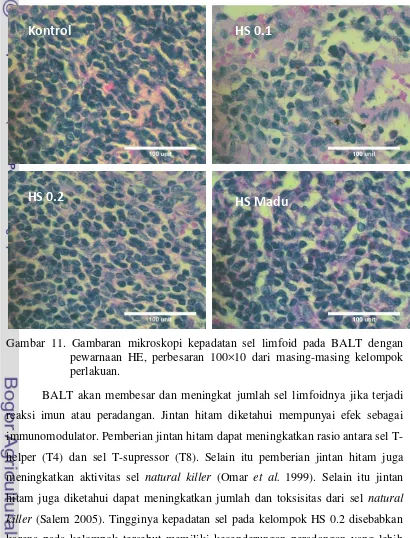
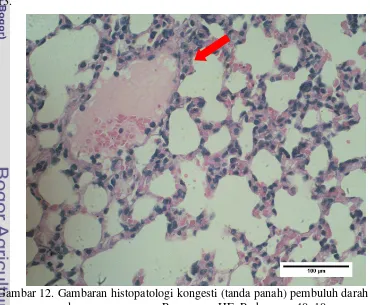
Pengaruh Pemberian Ekstrak Minyak Jinten Hitam (Nigella sativa) Terhadap Gambaran Mikroskopis Paruparu Mencit (Mus musculus)
Teks penuh
Gambar


Dokumen terkait
5.4 Hasil Uji Efek Ekstrak Etanol Serbuk Biji Jinten Hitam ( Nigella sativa) Terhadap Profil Bakteri Probiotik Mencit ( Mus musculus )
Pada penelitiaan ini menunjukkan tidak adanya perbedaan yang nyata dari penggunaan dosis 0,1 dan 0,2 ml/ekor ekstrak minyak jintan hitam terhadap luas ovarium, luas folikel
Bahan-bahan yang digunakan dalam penelitian ini adalah ekstrak protein biji jinten hitam ( Nigella sativa L.), hewan uji mencit strain Deutschland, Danken and Yoken
Penelitian ini menggunakan 6 perlakuan dengan 6 kali ulangan yang bertujuan untuk mengetahui pengaruh dari ekstrak biji jintan hitam (Nigella sativa L.) yang dikombinasikan
Skripsi dengan judul : Pengaruh Pemberian Terapi Adjuvan Minyak Jinten Hitam ( Nigella sativa ) Terhadap Hitung Limfosit Mencit Balb/C Model Sepsis.. Ricky Trinugroho Yuliantoro, NIM
Abstrak: Penelitian ini bertujuan untuk menganalisa pengaruh pemberian ekstrak etanol biji jinten hitam( Nigella Sativa ) terhadap ekspresi ET - 1 Aorta pada mencit
Berdasarkan hasil penelitian dapat disimpulkan bahwa pengaruh pemberian ekstrak jintan hitam (Nigella sativa) terhadap mencit hamil tidak menghambat pertumbuhan
Dari hasil penelitian tentang efek antimikroba minyak jintan hitam (Nigella sativa) terhadap pertumbuhan Escherichia coli, dapat diambil simpulan bahwa minyak jintan hitam