PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-DIPHENYL-2-PIKRILHYDRAZIL) EKSTRAK METANOLIK UMBI BIDARA UPAS (Merremia mammosa (Lour) Hallier f.) SKRIPSI Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar S
Teks penuh
Gambar

Dokumen terkait
Telah dilakukan penelitian tentang daya antioksidan ekstrak etanol umbi ketela rambat ( Ipomoea batatas (L.)L.) varietas ungu yang digoreng terhadap DPPH..
Menyatakan Bahwa skripsi yang berjudul “Uji Aktivitas Antioksidan Ekstrak Etanol Buah Kecipir ( Psophocarpus tetragonolobus L) dengan Metode DPPH
KARAKTERISASI DAN UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL KULIT BATANG LANDOYUNG (Litsea cubeba (Lour.) Pers.) DENGAN METODE DPPH.. SERTA ANALISIS
Tujuan penelitian ini adalah untuk mengetahui aktivitas antioksidan dari fraksi eter dan air ekstrak metanolik belimbing wuluh (Averrhoa bilimbi L.) terhadap radikal DPPH dan
Untuk mengetahui pengaruh pemberian kombinasi 2,4-D dan BA terhadap induksi kalus bidara upas ( Merremia mammosa (Lour.) Hallier f.) melalui teknik kultur in vitro.. Untuk
Tujuan penelitian ini adalah untuk mengetahui aktivitas antioksidan dari fraksi eter dan air ekstrak metanolik belimbing wuluh ( Averrhoa bilimbi L. ) terhadap radikal DPPH
Perlu dilakukan penelitian lebih lanjut pada pemberian ekstrak umbi bidara upas (Merremia mammosa (Lour)) dengan menggunakan tikus yang diterminasi pada hari
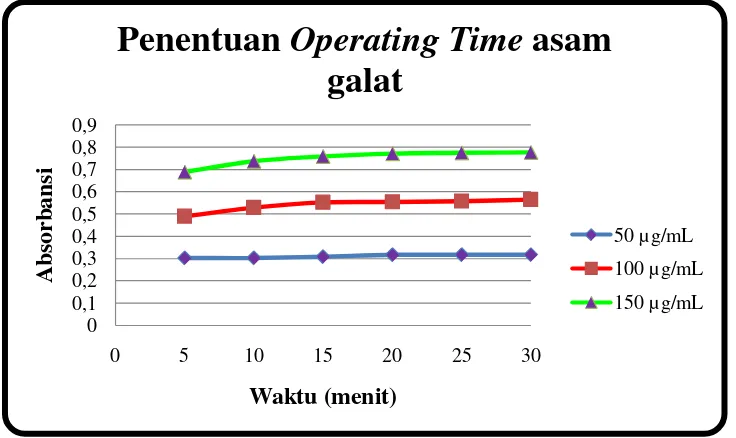
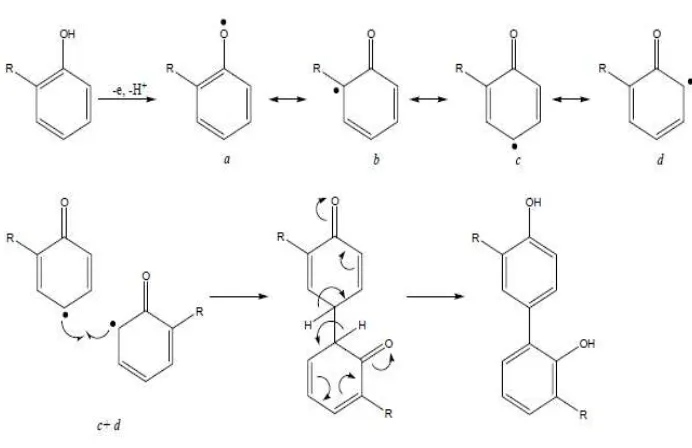
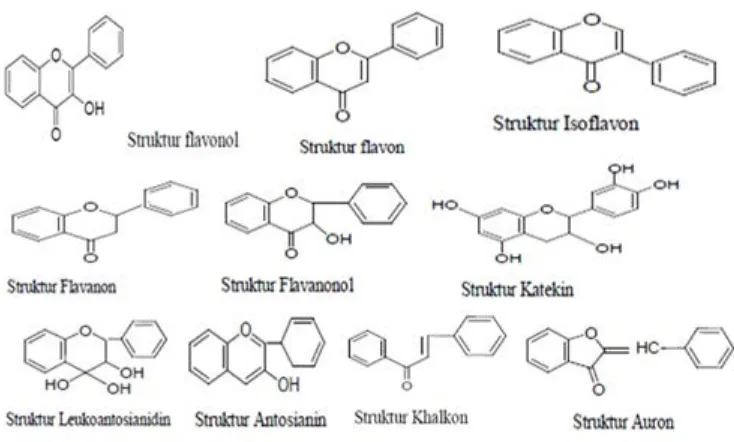
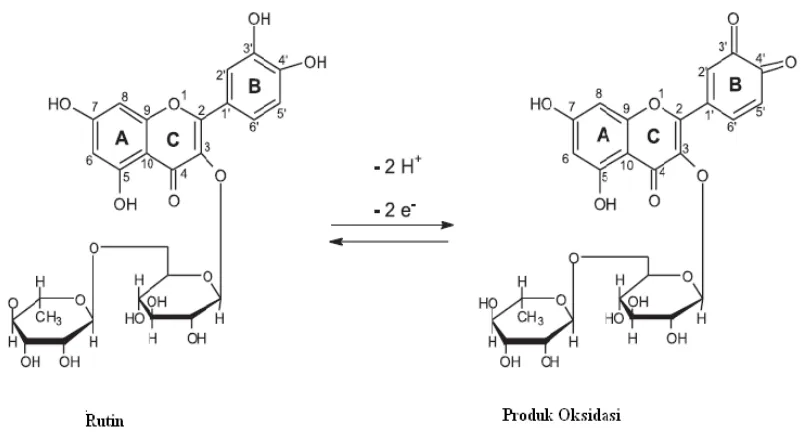
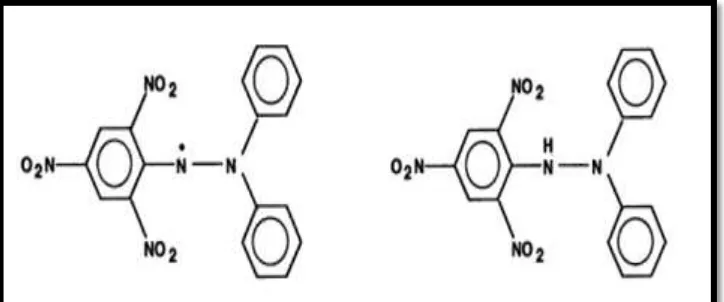
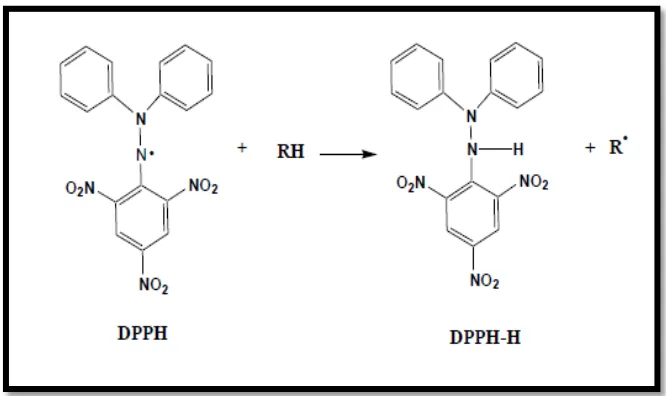
Metode yang dilakukan untuk uji aktivitas antioksidan adalah metode pemerangkapan radikal bebas 1,1- diphenyl-2-picryhydrazil (DPPH) dan kandungan fenolik total metode
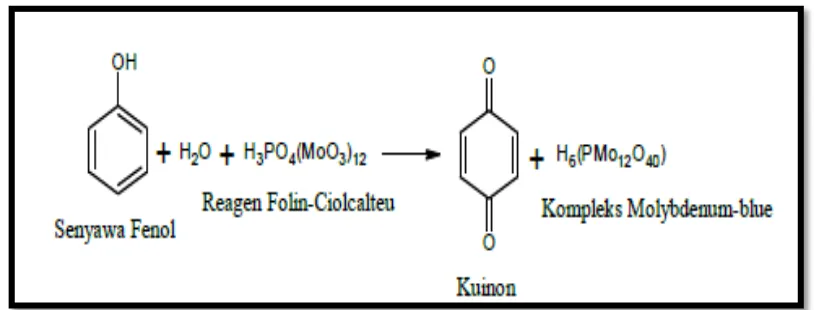
![Gambar 9. (A= Kontrol positif [Asam galat + Folin Ciocalteu], B= Larutan uji](https://thumb-ap.123doks.com/thumbv2/123dok/1804726.2099127/62.595.225.402.581.696/gambar-kontrol-positif-asam-galat-folin-ciocalteu-larutan.webp)
![Gambar 10. (A=Kontrol negatif [blanko DPPH], B= Kontrol positif [Rutin + DPPH], C= Larutan uji [Ekstrak metanolik umbi bidara upas + DPPH])](https://thumb-ap.123doks.com/thumbv2/123dok/1804726.2099127/63.595.185.441.499.670/gambar-kontrol-negatif-kontrol-positif-larutan-ekstrak-metanolik.webp)