Mudah dan aktif Belajar Kimia 3 IPA Kelas 12 Yayan Sunarya Agus Setiabudi 2009
$1.00
308
0
0
Teks penuh
Gambar




+7
Garis besar
Evaluasi Kompetensi Bab 1 A Pilihlah salah satu jawaban yang paling tepat.
Evaluasi Kompetensi Bab 2 A Pilihlah salah satu jawaban yang paling tepat.
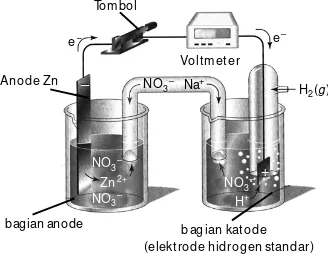
Kegiatan InkuiriKata Kunc
Kegiatan InkuiriBerdasarkan sifat periodik unsur-
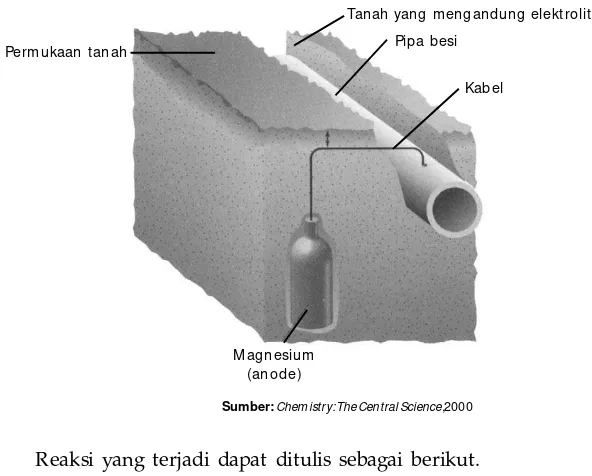
Aluminium dan Senyawanya
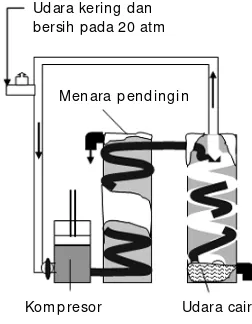
Evaluasi Kompetensi Bab 3 A Pilihlah salah satu jawaban yang paling tepat.
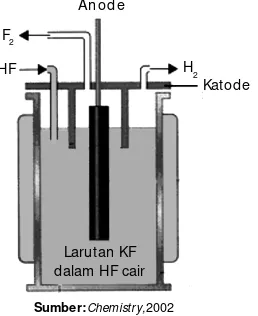
Evaluasi Kompetensi Bab 4 A Pilihlah salah satu jawaban yang paling tepat.
Evaluasi Kompetensi Kimia Semester
Alkohol dan Eter
Kata Kunci • Gugus alkoks
Mudah dan aktif Belajar Kimia 3 IPA Kelas 12 Yayan Sunarya Agus Setiabudi 2009
Dokumen terkait