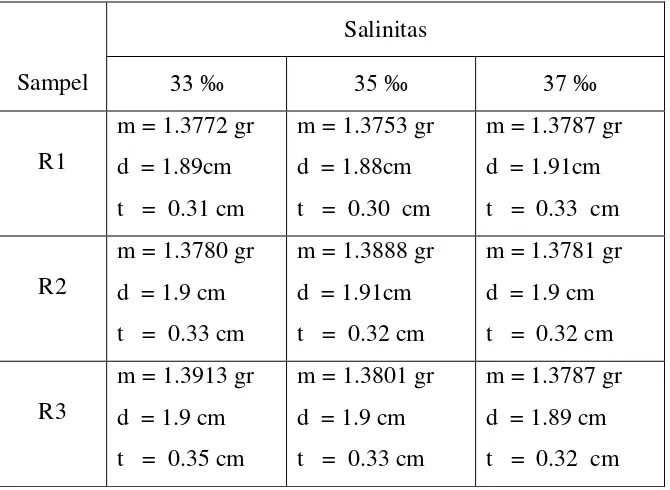
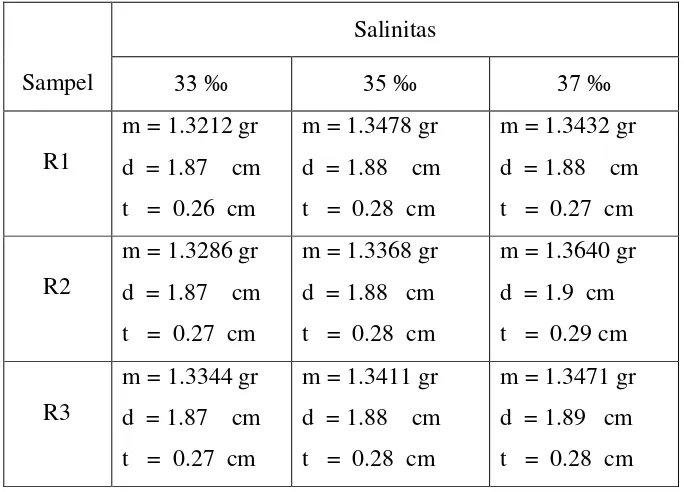
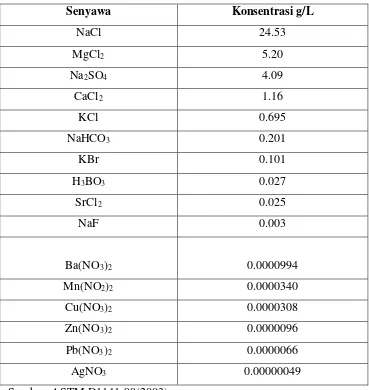
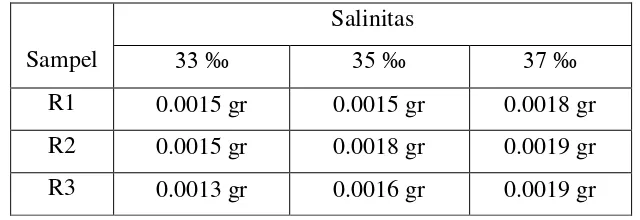
Pengaruh Bakteri Azotobacter, Bacillus Subtilis, Dan Pseudomonas Putida Terhadap Laju Korosi Alumunium 6063 - ITS Repository
Teks penuh
Gambar
Dokumen terkait
Metode penelitian yang digunakan dalam penelitian ini adalah kualitatif deskriptif dengan pendekatan studi kasus yang fokus pada Strategi Komunitas Betawi
Laporan Kinerja Balai Perikanan Budidaya Laut Ambon Triwulan I Tahun 2020 menyajikan berbagai keberhasilan maupun kendala dalam mencapai Sasaran Strategis Balai
Mahasiswa mampu menyusun program (melalui praktikum) yang dengan alur logika bersyarat dan berulang dan menggunakan struktur data larik (array), serta subprogram
Kompensasi lansung terdiri dari : Upah atau gaji pokok, Tunjangan tunai sebagai suplemen upah atau gaji yang diterima setiap bulan, Tunjangan hari raya keagamaan, Bonus
Hasil penel itian pada tabel 1 m enunjukkan bahwa nil ai efisi ensi penghilangan TSS tinggi, sebagian besar m el ebihi 80% hanya efisi ensi penghilangan air lim bah
Στην πραγματικότητα δεν είχε ιδέα πώς ήταν η όψη του στη διάρκεια της μέρας τώρα που είχε πατήσει τα σαράντα· αν απαλύνονταν οι ρυτίδες
• Sebuah jaringan pengetahuan memelihara database ahli perusahaan, serta solusi diterima untuk masalah yang dikenal, dan kemudian memfasilitasi komunikasi antara karyawan
keputusan baik bagi pribadinya maka disebut baik, sedangkan jika keputusan tersebut tidak baik maka itulah yang buruk; (2) hedonisme rasional/rationalistic hedonism yang