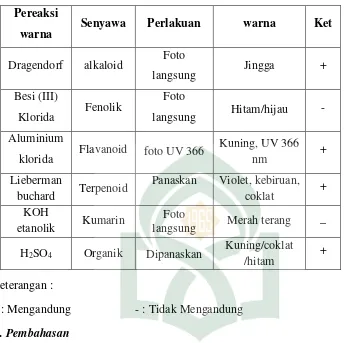
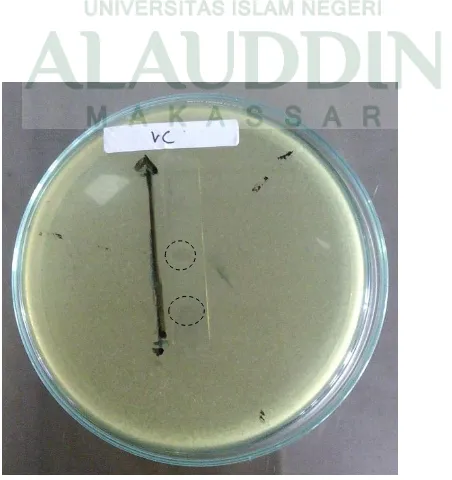
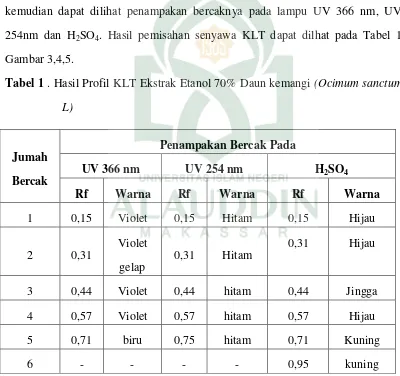
Uji Aktivitas Antibakteri Ekstrak Daun Kemangi (Ocimum Sanctum L) Terhadap Bakteri Patogen Dengan Metode KLT Bioautografi - Repositori UIN Alauddin Makassar
Teks penuh
Gambar



Dokumen terkait
Setiap 3 bulan sekali (tri wulan) Dinas Pendidikan Provinsi Lampung menerima laporan penerimaan dan penyerapan dana (LPPDI) serta laporan pengiriman dan
Tujuan umum dilaksanakannya penelitian ini untuk mengetahui perbedaan keefektifan penerapan model pembelajaran kooperatif tipe STAD dan TPS terhadap aktivitas dan hasil belajar
Penelitian ini bertujuan untuk (1) mengetahui apakah terdapat pengaruh model pembelajaran Kooperatif Tipe Team Assisted Individualization (TAI) terhadap kemampuan berpikir
Sementara itu, Abas Nurga- ha, aktivis muda Partc:!.i Golkar Jabar mengatakan, masalah yang terjadi di tubuh Golkar Jabar yaitu kemandekan ka- derisasi karena Golkar merasa..
Memperhatikan ketentuan-ketentuan Peraturan Presiden Republik Indonesia Nomor 54 Tahun 2010 tentang Pengadaan Barang/Jasa Pemerintah yang terakhir diubah dengan
BAPETEN sebagai badan pengawas yang memiliki tujuan untuk menjamin keselamatan pekerja, masyarakat serta perlindungan terhadap lingkungan hidup memiliki beberapa
Berdasarkan jawaban produsen tentang indikator hak-hak konsumen dalam Islam dapat dilihat dan disimpulkan bahwa produsen makanan ringan industri rumah tangga
pembatasan waktu penangkapan dan penahanan, pemberian ganti rugi dan