Pengendalian Serangan Busuk Pangkal Batang (Ganoderma boninense Pat.) Pada Bibit Tanaman Kelapa Sawit (Elaeis guineensis Jacq.) Menggunakan Isolat Bakteri Kitinolitik
Teks penuh
Gambar



Dokumen terkait
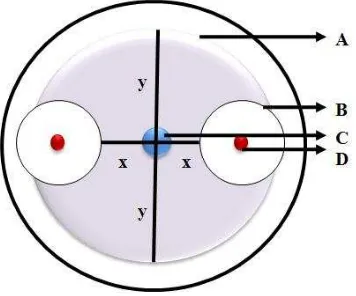
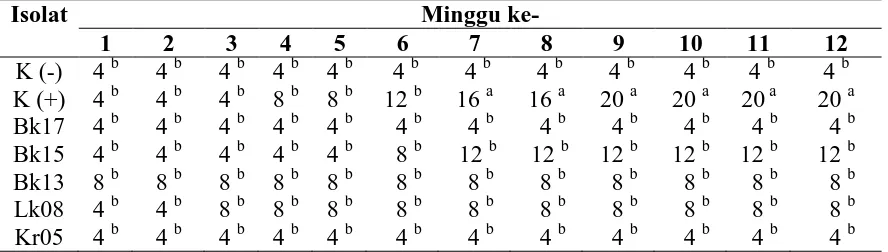
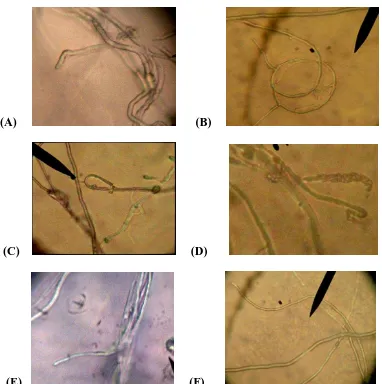
: Areal tanaman yang terinfeksi penyakit Ganoderma dengan skala 4, 3,2 1 Dari hasil pengamatan di lapangan, gejala serangan pada tanaman dibedakan ke dalam 2 kelompok,
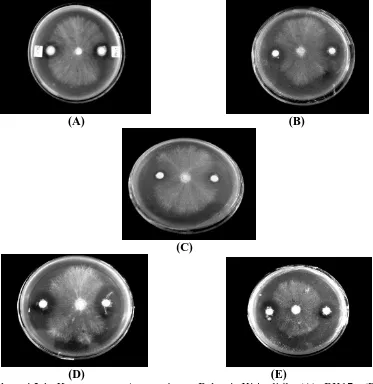
Dari hasil penelitian tentang isolasi dan uji antagonis bakteri endofit akar dan daun kelapa sawit ( Elaeis guineensis Jacq.) terhadap Ganoderma boninense Pat., dapat
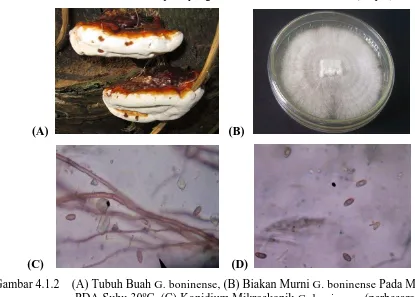
Salah satu penyakit penting pada tanaman sawit adalah Busuk Pangkal Batang (BPB) kelapa sawit yang disebabkan oleh Ganoderma boninense yang merupakan penyakit
Perlakuan beberapa pupuk cair urine hewan pada bibit kelapa sawit umur 3-7 bulan berpengaruh terhadap pertambahan tinggi bibit, pertambahan diameter bonggol,
isolat MV 27 merupakan FMA yang terbaik untuk pertumbuhan bibit kelapa sawit dibandingkan dengan FMA lainnya dan tanpa FMA yang dilihat melalui nilai tengah jumlah daun
Pemberian kapur dolomit, pupuk kimia dan isolat bakteri pereduksi sulfat dapat meningkatkan pertambahan diameter batang tanaman bibit kelapa sawit lebih baik dari
Kombinasi perlakuan terbaik adalah perbandingan kompos TKKS dengan top soil 2:6 dan pemberian pupuk hayati setiap bulan dengan peningkatan pertumbuhan bibit kelapa
isolat MV 27 merupakan FMA yang terbaik untuk pertumbuhan bibit kelapa sawit dibandingkan dengan FMA lainnya dan tanpa FMA yang dilihat melalui nilai tengah jumlah daun sebesar 10,5