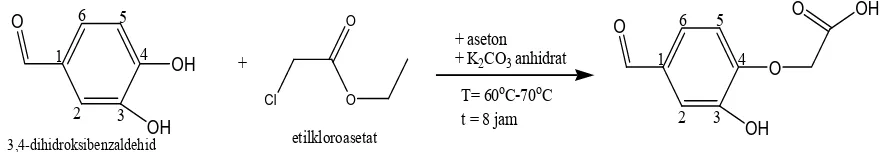
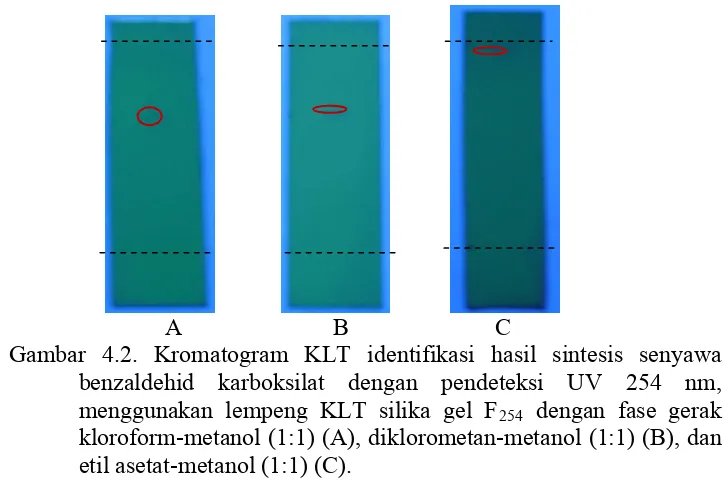
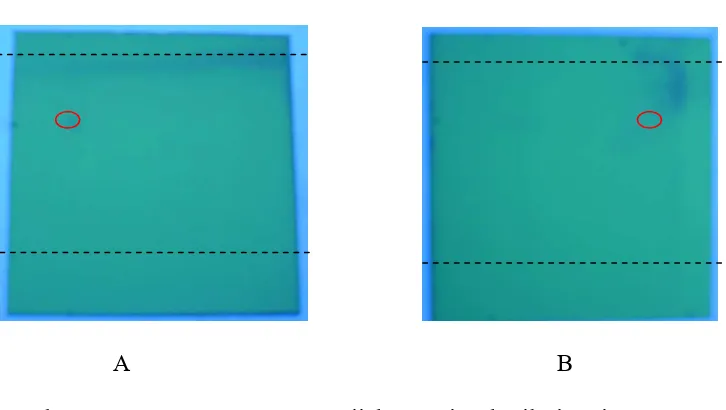
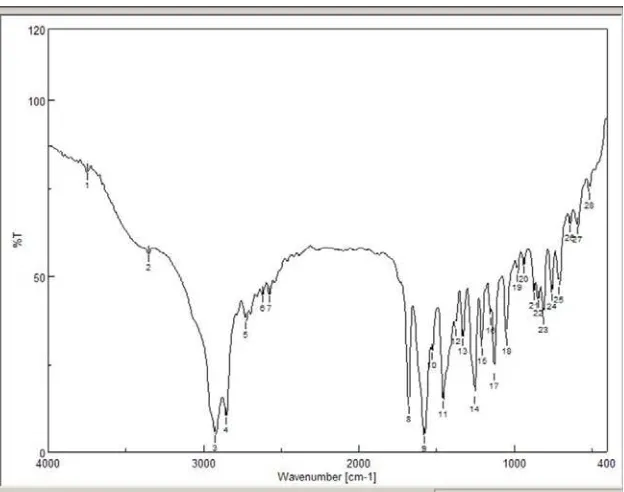
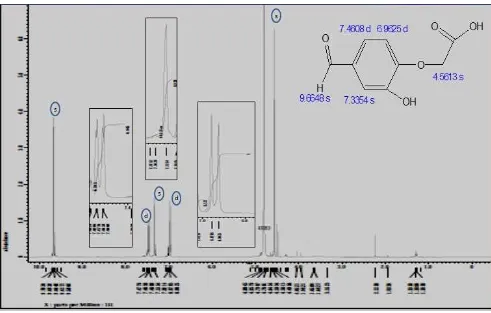
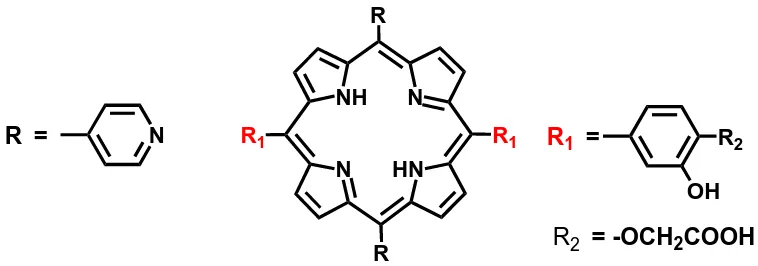
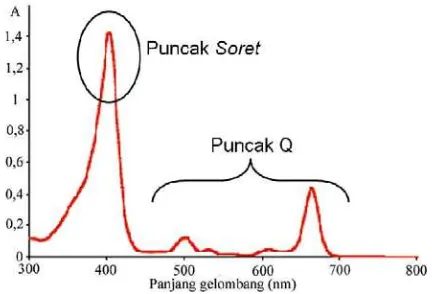
Sintesis Porfirin Pembawa Gugus Karboksilat Sebagai Ligan Untuk Kit Radiofarmaka
Teks penuh
Gambar

Dokumen terkait
Tujuan umum penelitian ini adalah untuk menguji senyawa quinocide sebagai ligan pada reseptor estrogen alfa secara in silico menurut protokol yang telah dikembangkan
Tujuan umum penelitian ini adalah untuk menguji senyawa quinocide sebagai ligan pada reseptor estrogen alfa secara in silico menurut protokol yang telah dikembangkan
Penelitian ini bertujuan untuk mensintesis suatu derivat kalkon, yaitu mono para hidroksi kalkon yang mengandung substituen bromo menggunakan katalis basa, dan
Spektrum FTIR (KBr) dari senyawa Pr(III)- 1,4-fenilendiamin (Tabel 2) memperlihatkan serapan vibrasi yang kuat dan melebar pada 3435 cm -1 yang menunjukkan adanya gugus
Dari beberapa penelitian menyebutkan bahwa senyawa kalkon yang mengandung gugus metilendioksi (-O-CH 2 -O- ) mempunyai aktivitas sebagai antibakteri, sehingga dalam penelitian ini
bahwa membran yang mengandung senyawa pembawa co-EDVB ini, komponen penyusun membran yang hilang didominasi oleh senyawa pembawanya sedangkan indikasi hilangnya
Ditizon merupakan ligan yang sensitif dan spesifik karena mengandung banyak atom donor N, gugus –NH yang sangat spesifik untuk berperan sebagai donor pasangan elektron
Karakterisasi FTIR bertujuan untuk mengidentifikasi gugus fungsi yang terdapat dalam senyawa ZnO dan komposit ZnO/Bentonit dengan ekstrak eceng gondok, karakterisasi XRD bertujuan untuk