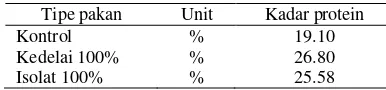
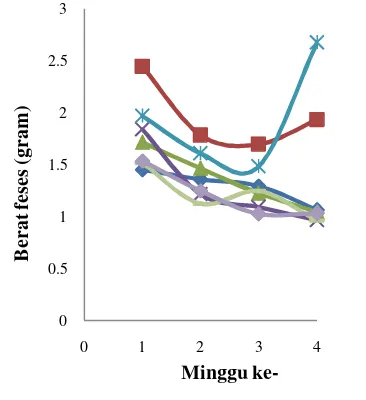
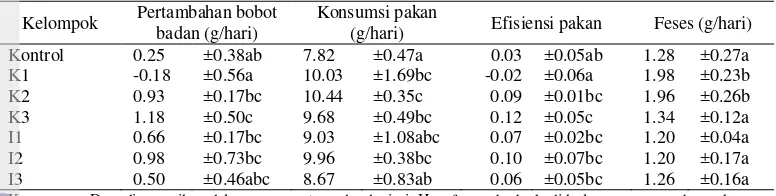
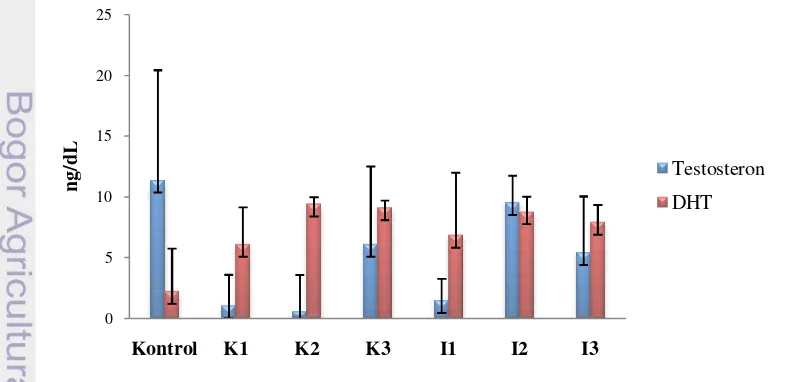
Efek Pakan Mengandung Isoflavon Kedelai terhadap Bobot Badan dan Kadar Androgen Serum Tikus Jantan
Teks penuh
Gambar
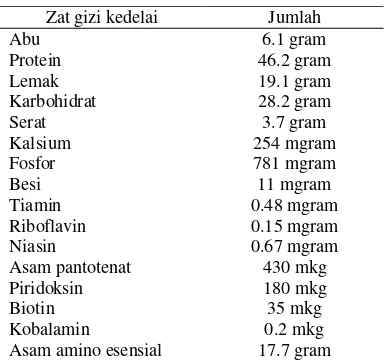
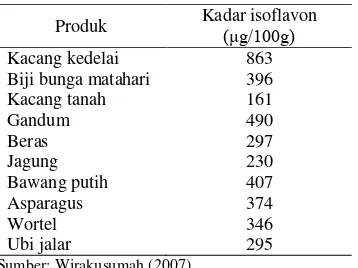
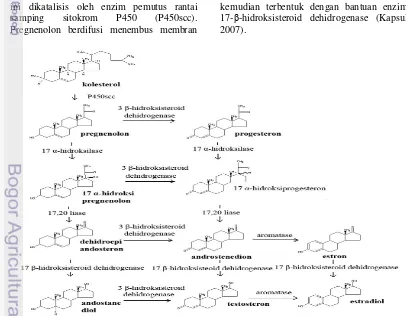

Dokumen terkait
Hasil penelitian di atas menunjukkan bahwa meningkatkan keterampilan proses sains siswa dapat dilakukan dengan cara melakukan pembelajaran di luar kelas atau
Sejalan dengan hasil penelitian yang dilakukan oleh Febrina (2011) dapat dikatakan bahwa leverage tidak berpengaruh signifikan terhadap kebijakan pengungkapan
Oleh karena probabilitas (0,000) jauh lebih kecil dari 0,05, maka model regresi dapat dipakai untuk memprediksi kemampuan shooting dalam permainan bola
mengenai efektivitas metode Extending Concept through Language Activities (ECOLA) dalam pembelajaran membaca dan diberi judul “Efektivitas Metode Extending Concept through
mata berdasarkan prinsip bagi hasil, tidak diperknankan melakukan kegiatan usaha yang tidak berdasarkan prinsip bagi hasil. 2) bank umum atau bank perkreditan
Peraturan Menteri Dalam Negeri Nomor 13 Tahun 2006 tentang Pedoman Pengelolaan Keuangan Daerah, sebagaimana telah diubah kedua kalinya dengan Peraturan Menteri Dalam Negeri
PENINGKATAN HASIL BELAJAR IPA MATERI ALAT PENCERNAAN PADA MANUSIA MELALUI STRATEGI GROUP INVESTIGATION PADA SISWA KELAS V SEMESTER.. I MI MA’ARIF SIDOM ULYO KECAMATAN SALAMAN
Menindaklanjuti hasil evaluasi kualifikasi pengadaan barang/jasa Pekerjaan Pembangunan 2 (Dua) Ruang Kelas Baru (RKB) SMPN 3 Cibadak dengan ini kami mengundang saudara untuk hadir