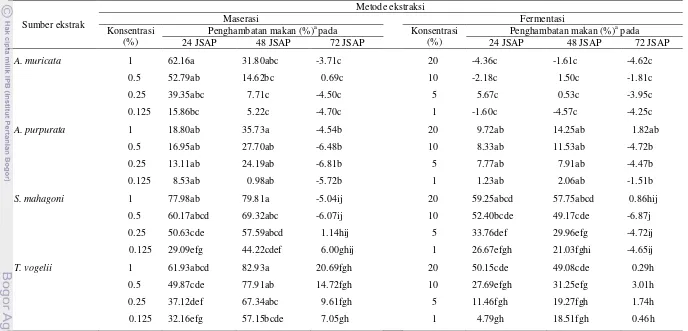
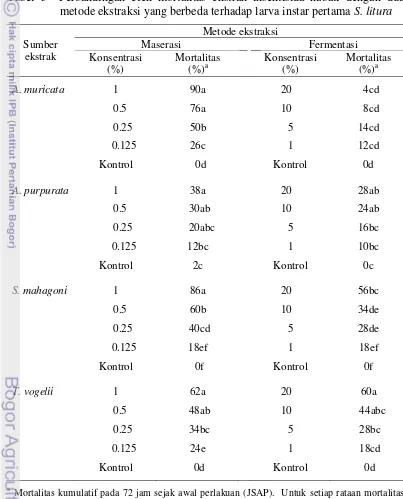
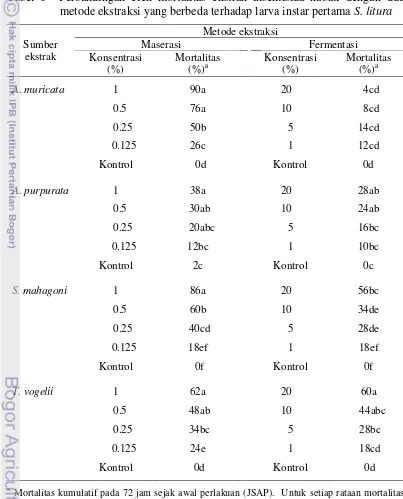
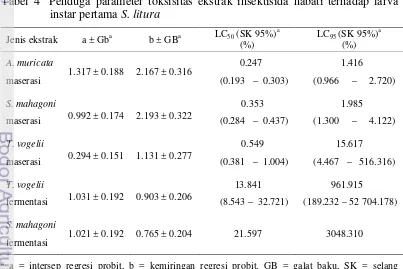
Keefektifan Insektisida Nabati dengan Dua Metode Ekstraksi yang Berbeda
Teks penuh
Gambar


Dokumen terkait
Tujuan penelitian adalah untuk: 1) Mengetahui hasil belajar peserta didik yang diajar dengan menggunakan modul alur cerita pada kelas VIII SMP Negeri 5 Maiwa. 2) Mengetahui hasil
16 Self stigma bagi ODHA merupakan bentuk internalisasi stigma, dimana seseorang melabeli dirinya sebagai tidak dapat diterima oleh masyarakat karena memiliki masalah
4.. penyelidik perfu merekabentuk kenderaan bawah-airnya sendiri. Oleh itu, sebuah kenderaan bawah-air yang diberi nama USM-AUV tetah direkabentuk. Rekabentuk kenderaan ini
rhamnosus SKG34 selama 21 hari dapat mengontrol kadar kolesterol, trigliserida dan LDL di dalam darah tetap stabil (normal) pada subjek dengan kadar. kolestrol
Secara khusus tulisan ini bertujuan: (1) menganalisis kebijakan partai politik dalam merespon pemberlakuan 30% keterwakilan perempuan dalam pencalonan
Sebab distribusi barang dari negara sendiri lebih sulit sehingga masyarakat cendrung melakukan aktifiktas ekonomi dengan negara tetangga yang pada umumnya akses transportasi
3) p bahwa pembajakan sudah merupakan hal yang biasa dan tidak lagi merupakan tindakan melanggar undang-undang. 4) Faktor pendidikan, selama ini masyarakat kurang mendapatkan
kegiatan pengabdian dan penyuluhan yang dilakukan pada tenun songket Winda adalah memberikan pembinaan tentang pengembangan dari hasil kain songket yang