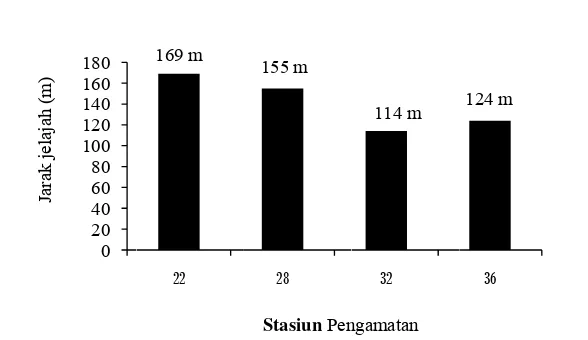
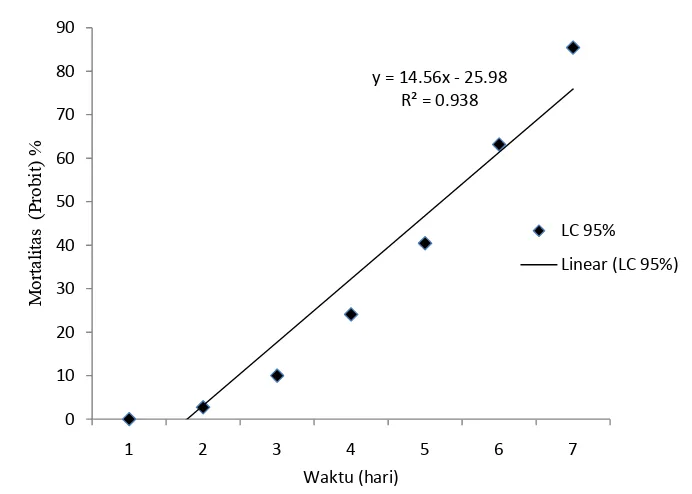
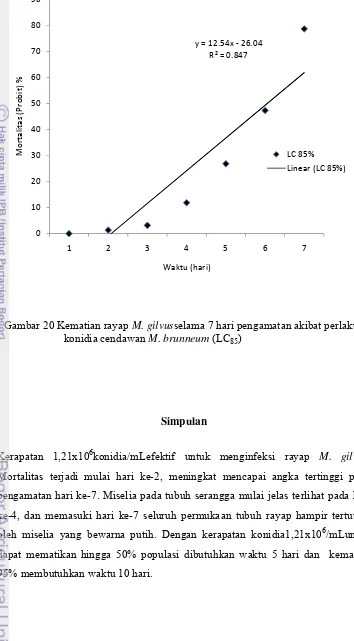
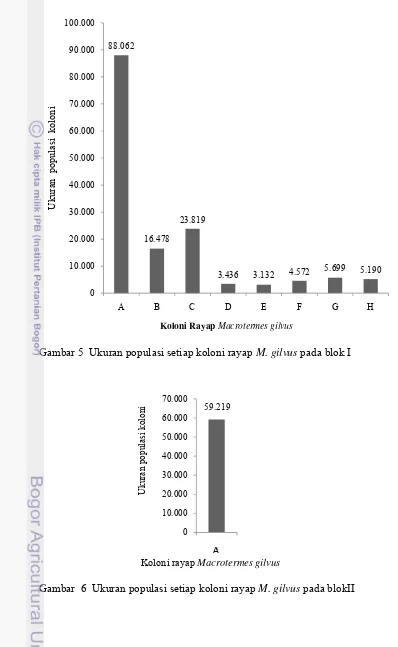
Kajian cendawan Entomopatogen Metarhizium brunneum Petch sebagai agens hayati terhadap rayap Macrotermes gilvus hagen (Isoptera: Termitidae) pada tanaman jarak pagar (Jatropha curcas L.)
Bebas
155
0
0
Teks penuh
Gambar


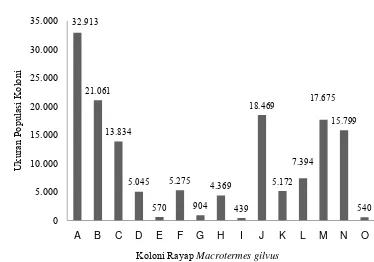
+7
Dokumen terkait
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi, Karakterisasi, dan Identifikasi Bakteri Selulolitik Simbion Usus Belakang Rayap Macrotermes gilvus
Dengan ini saya menyatakan bahwa skripsi berjudul Survei Trips dan Cendawan Entomopatogen pada Tanaman Krisan di Perusahaan Bunga Potong Natalia Nursery adalah
Oleh sebab itu, salah satu cara teknologi pengendalian rayap dengan menggunakan agens pengendali hayati berupa nematoda entomopatogen yang ramah lingkungan, murah,
Dengan ini saya Nama: Dhony Krisdhianto NIM: H0709028 Program Studi: Agroteknologi menyatakan bahwa dalam skripsi saya yang berjudul “KERAGAMAN HAYATI CENDAWAN MIKORIZA ARBUSKULAR