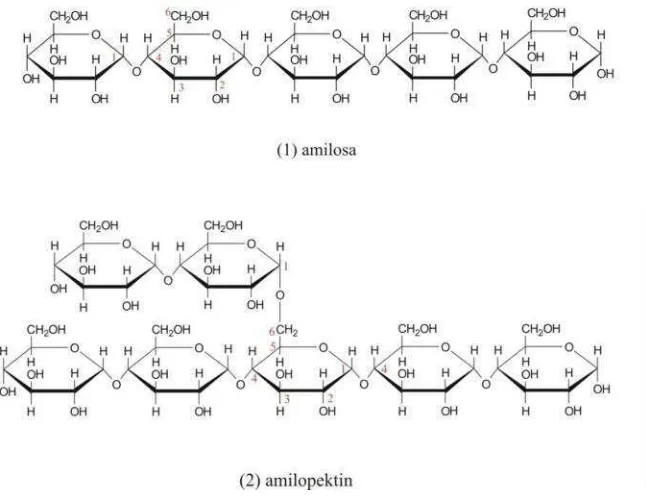
PENGARUH BEBERAPA FAKTOR PADA MEDIUM KULTUR TERHADAP PRODUKSI ENZIM AMILASE DARI BAKTERI AMILOLITIK ISOLAT LOKAL
Teks penuh
Gambar

Dokumen terkait
The Objective On This Research Is To Find: The Improvement Of The Learning Outcomes Of Back-Roll Material In Floor Gymnastics Through Learning Variation In The 11
[r]
Berdasarkan hasil analisis data yang telah dipaparkan pada BAB IV, dapat ditarik kesimpulan mengenai kegiatan yang dilakukan guru Sekolah Dasar Islam Terpadu Internasional
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM Karangmalang Yogyakarta 5528.1 , Telp 586168, pesawal 217 ,
Formulir Pemesanan Pembelian Unit Penyertaan beserta bukti pembayaran yang diterima secara lengkap dan disetujui oleh Manajer Investasi atau Agen Penjual Efek Reksa Dana yang
- Karnaugh Map hanya cocok digunakan jika fungsi Boolean mempunyai jumlah variable paling banyak 6 buah, jika variable yang terlibat pada suatu fungsi
Dengan adanya penelitian ini, diharapkan dapat mengalisis bagaimana dan seberapa besar pengaruh variabel inflasi dan pendidikan terhadap tingkat pengangguran di Sumatera
Nurhadi |Cerai Bersyarat (Shighat Ta’liq) menurut Dual Sistem Hukum.... 30 Begitu juga berdasarkan hadis yang diriwayatkatkan Imam Bukhari dalam hal perjanjian. Kata