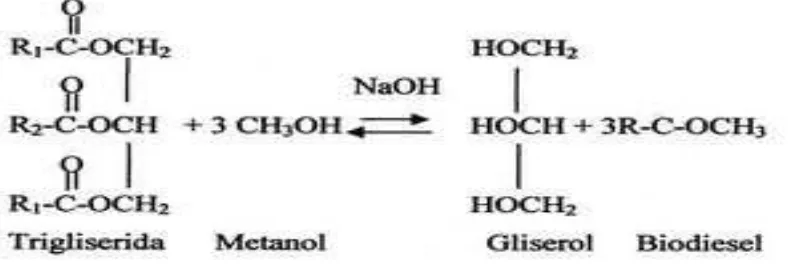
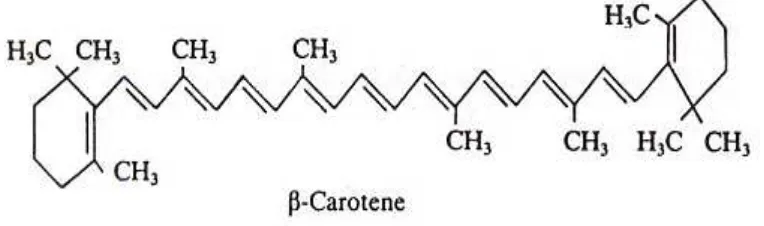
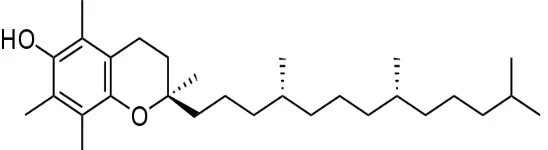
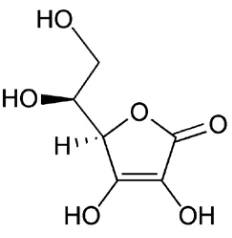
Uji Aktivitas Antioksidan Minyak Serat Mesokarp Buah Kalapa Sawit (Elaeis Guineensis Jacq)
Teks penuh
Gambar
Dokumen terkait
[r]
Pada saat pengakuan awal, Grup mengklasifikasikan instrumen keuangan dalam kategori berikut: aset keuangan yang diukur pada nilai wajar melalui laporan laba rugi, pinjaman
International Archives of the Photogrammetry, Remote Sensing and Spatial Information Sciences, Volume XXXVIII-5/W16, 2011 ISPRS Trento 2011 Workshop, 2-4 March 2011, Trento,
Pada saat pengakuan awal, Grup mengklasifikasikan instrumen keuangan dalam kategori berikut: aset keuangan yang diukur pada nilai wajar melalui laporan laba rugi, pinjaman
The most frequently employed snow cover fraction methods applied on Moderate Resolution Imaging Spectroradiometer (MODIS) data have evolved from spectral unmixing and empirical
[r]
Membawa semua dokumen ASLI sesuai SCAN DOKUMEN yang diupload pada tahap Pemasukan dokumen penawaran serta dokumen-dokumen lain yang dipersyaratkan dalam dokumen
Demikian kami sampaikan, atas perhatiannya kami ucapkan terima kasih.. TUNGKAL