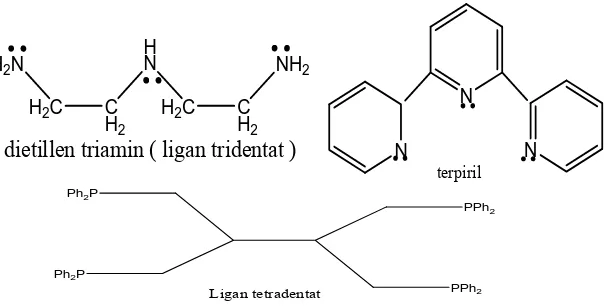
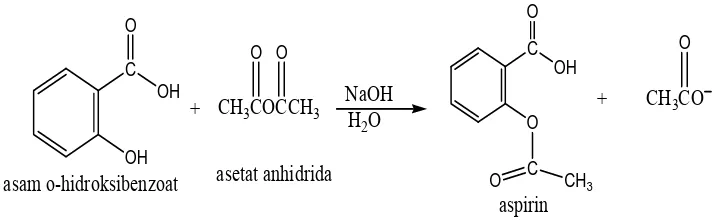
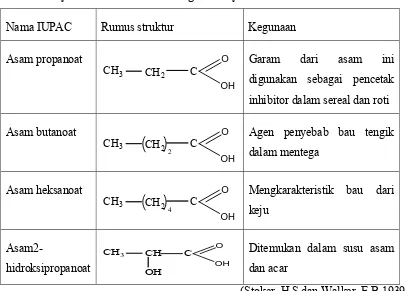
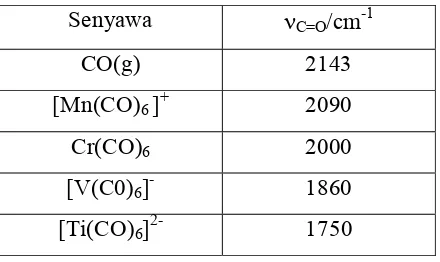
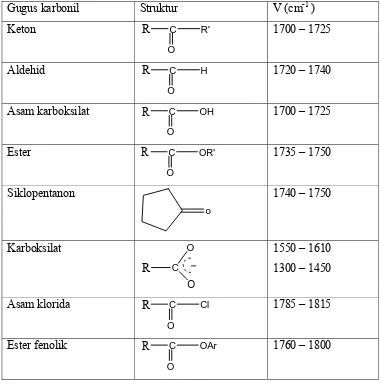
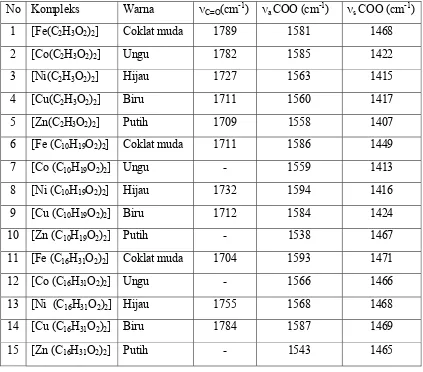
Studi Infra Merah Dari Kompleks Fe(II), Co(II), Ni(II), Cu(II), Zn(II) dengan Anion karboksilat.
Teks penuh
Gambar
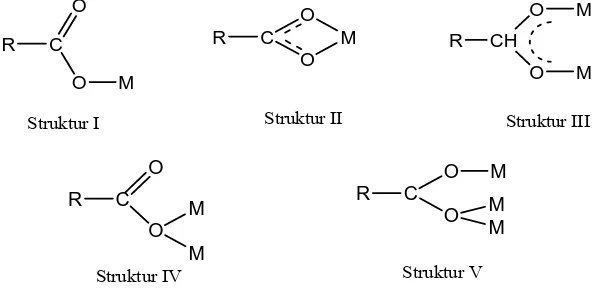
![Gambar 1.2 Struktur [Fe(III)-(EDTA)]](https://thumb-ap.123doks.com/thumbv2/123dok/395709.38325/17.595.240.349.324.473/gambar-struktur-fe-iii-edta.webp)

Dokumen terkait
Maka dari hasil analisis itu dapat disimpulkan bahwa kadar logam berat : Kadmium (Cd), Cuprum (Cu), Chrom (Cr), Ferrum (Fe), Nikel Ni), Zinkum (Zn) belum melampaui nilai ambang
Kompleks Fe(II)-sulfanilat telah disintesis pada perbandingan mol logam dengan mol ligan 1:6 dalam pelarut metanol.. Terbentuknya kompleks ditandai dengan
Penentuan panjang gelombang maksimum pada senyawa kompleks digunakan untuk menentukan stokiometri antara ion logam Cu(II) dengan ligan melalui metode variasi kontinu..
PENDAHULUAN BIOAKTIVITAS SENYAWA KOMPLEKS CISPLATIN Efek samping SENYAWA KOMPLEKS BARU KOMPLEKS LOGAM NON- PLATINUM LIGAN ORGANIK LOGAM TRANSISI ESENSIAL Toksisitas ↑... LOGAM
Untuk itu pada penelitian ini dilakukukan sintesis kompleks dari ion logam Zn(II) yang dikoordinasikan dengan ligan 2,6-bis(4-nitrobenzamido)piridin (BNBP) dengan
PENDAHULUAN BIOAKTIVITAS SENYAWA KOMPLEKS CISPLATIN Efek samping SENYAWA KOMPLEKS BARU KOMPLEKS LOGAM NON- PLATINUM LIGAN ORGANIK LOGAM TRANSISI ESENSIAL Toksisitas ↑... LOGAM
Keberadaan ion logam lain yaitu Fe(III), Co(II), Ni(II), Cu(II), Cd(II) dan Zn(II) dalam larutan dengan konsentrasi dan pH larutan yang bervariasi, tidak memberikan
Kompleks seng-kobalt dengan ligan asam piridin-2,6-dikarboksilat disintesis dengan mengacu pada metode penelitian yang telah dilakukan sebelumnya [13].. Kompleks