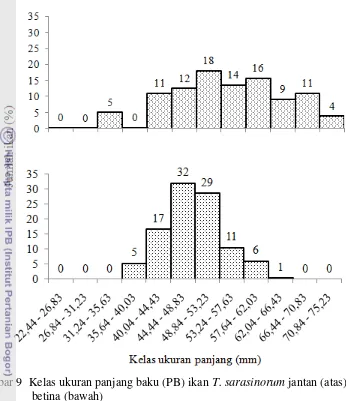
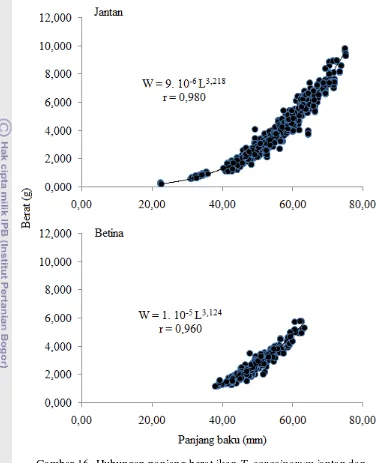
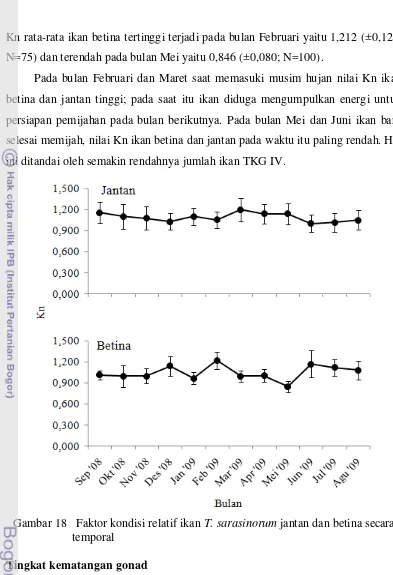
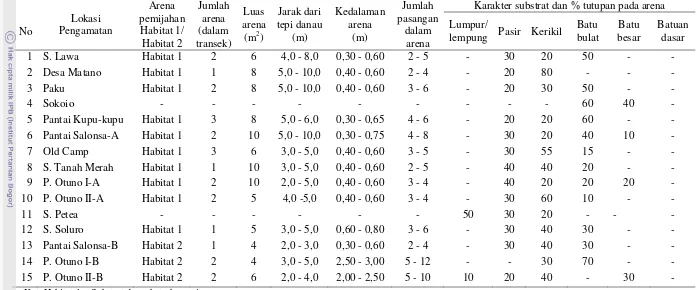
Reproduksi ikan Telnatherina sarasinorum (Kottetat, 1991) sebagai dasar konservasi di danau Matano Sulawesi Selatan
Teks penuh
Gambar

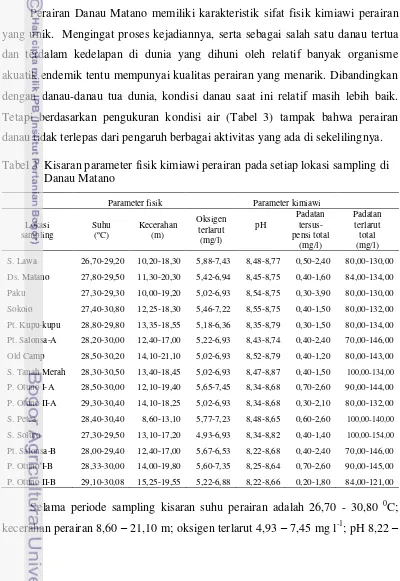
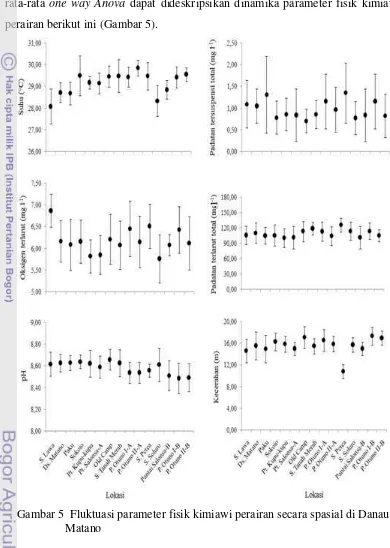
Dokumen terkait
Diperlukan seorang asisten untuk membantu, sehingga bersegeralah minta bantuan. Jangan melakukan tarikan atau dorongan sebelum memastikan bahwa bahu posterior sudah
Pengurus Komisi Beasiswa mengucapkan terimakasih kepada seluruh jemaat/Donatur HKBP Kebayoran Baru yang telah bersama-sama mengumpulkan dana memperjuangkan bantuan
kelincahan pada atlet S bulutangkis PB. Maka tidak ada pengaruh latihan yang signifikan pada peningkatan kelincahan pada atlet bulutangkis PB. Jaya Raya Abadi
Berdasarkan hasil penelitian di atas terbukti bahwa pembelajaran melalui metode Two Stay Two Stray dapat meningkatkan kreativitas dan hasil belajar matematika siswa kelas IX
Perusahaan Daerah Air Minum (PDAM) Kabupaten Jembrana sesuai dengan Peraturan Daerah Nomor 15 Tahun 1991 tentang Pendirian Perusahaan Daerah Air Minum Kabupaten Daerah Tingkat
If running SonicOS Enhanced, the SonicWALL TZ 170 is the lowest- end model in the SonicWALL product line that can support features such as WAN failover and load balancing.The TZ
Segala puji bagi Allah SWT yang telah memberikan Kemudahan, rahmat, karunia dan ni’mat sehingga penulis dapat menyelesaikan skripsi yang berjudul “PERAN BAITUL MAAL WA
Berdasarkan uraian di atas maka dirumuskanlah masalah penelitian yaitu faktor–faktor apa yang berhubungan dengan daya terima makanan lunak pasien rawat inap