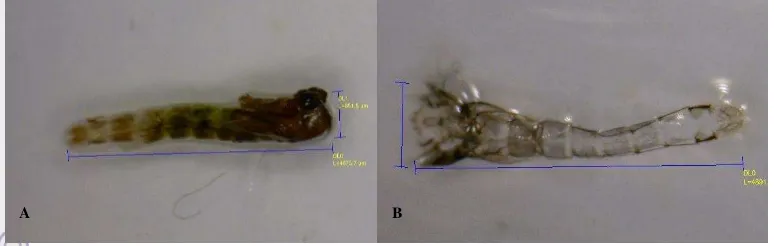
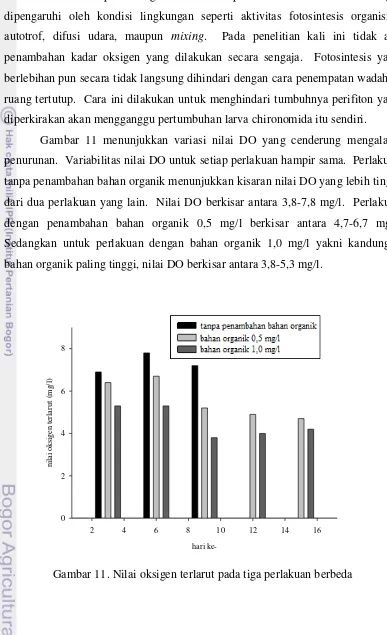
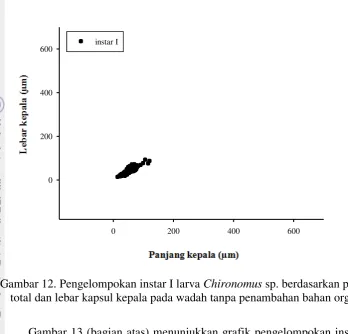
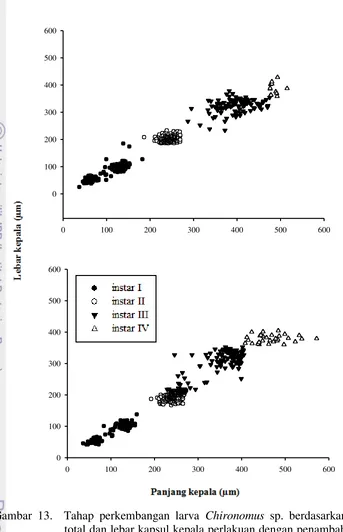
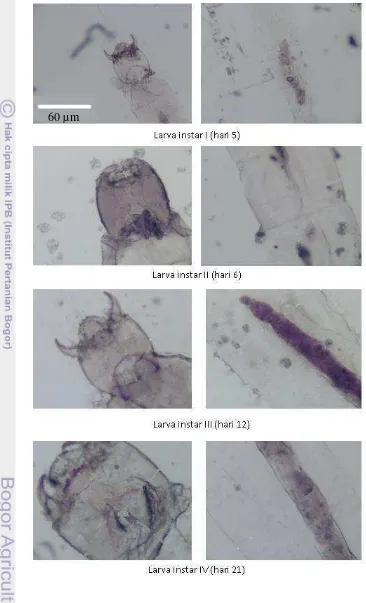
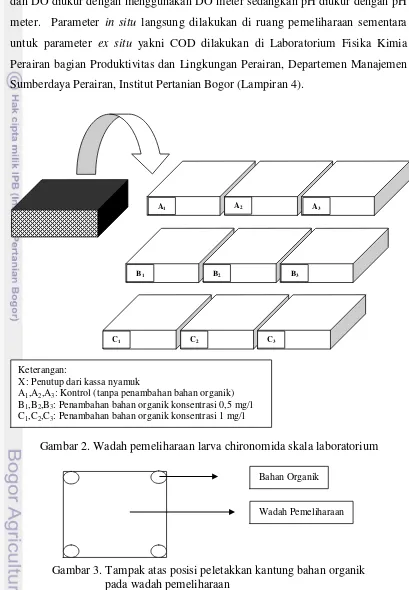
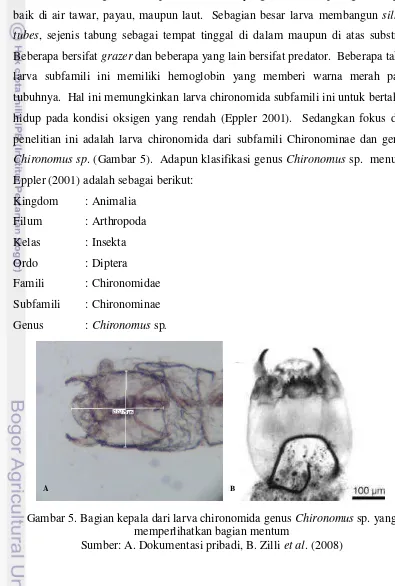
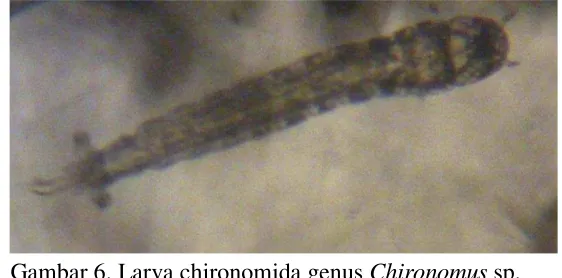
Pertumbuhan dan Perkembangan Larva Chironomus sp. pada Level Bahan Organik Berbeda dalam Skala Laboratorium
Teks penuh
Gambar

Dokumen terkait
Selanjutn ya, catatan memberitahukan kepada kita, ketika pikiran beliau telah tenang secara sempurna, pada jam malam per tama Beliau mampu mengingat kelahiran-kelahiran lampaun
Jika Tertanggung mengalami Kecelakaan dan dalam jangka waktu 90 (sembilan puluh) hari sejak tanggal terjadinya Kecelakaan tersebut Tertanggung meninggal dunia sebelum mencapai Usia
Daging kambing merupakan salah satu daging yang termasuk dalam kelas daging merah, seperti yang kita ketahui daging merah sangat penting untuk dikonsumsi saat anda mengalami
Hipotesis tindakan dalam penelitian adalah model Numbered Head Together dapat meningkatkan prestasi belajar, kinerja guru dalam pembelajaran dan aktivitas belajar
Untuk WPS/PQR dalam suatu Company atau satu Quality Sistem (lihat di ASME IX) dapat dipakai WPS/PQR yg sama , untuk proyek yang lainnya selama essential variabel tidak
Maka dari masalah-masalah peran perempuan yang masih diabaikan sampai saat ini membuat penulis ingin memperlihatkan bahwa sebenarnya dalam gerakan reformasi itu
Dari sketsa desain yang telah dibuat pada masing-masing media utama dan media pendukung, maka akan akan terpilih satu desain sebagai acuan untuk semua media maupun pembuatan buku
BSRE1 - BSR