Seleksi dan Karakterisasi Bakteri Penghasil Siderofor sebagai Agens Antagonis Ralstonia solanacearum pada Tomat
Teks penuh
Gambar


Dokumen terkait
Puji syukur penulis ucapkan kepada Allah SWT atas rahmat dan karunia- Nya sehingga skripsi dengan judul 'Seleksi dan Karakterisasi Bakteri Rizosfer untuk Mengzndalikan
Penelitian ini dilakukan 2 tahap yaitu tahap I : dilakukan dilaboratorium dengan menguji kemampuan bakteri antagonis yang hidup di rhizofer tanaman graminae yang diisolasi
Tujuan penelitian ini ialah untuk mengetahui potensi agens hayati dan bahan nabati ekstrak daun sirih dan ekstrak kubis sebagai pestisida alternatif dalam menekan
Hasil pengamatan secara makroskopis menunjukkan bahwa pada perlakuan kontrol dengan menggunakan aquades tidak tampak adanya plak yang muncul, berbeda pada pengenceran
Ralstonia solanacearum dalam tanah pada rizosfer tanaman tomat untuk melihat dampak aplikasi serbuk daun mengkudu, daun salam dan daun sirih, menunjukkan bahwa
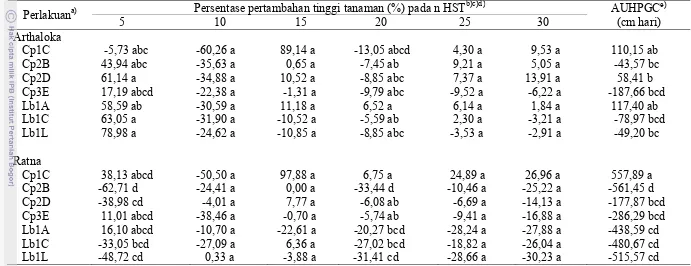
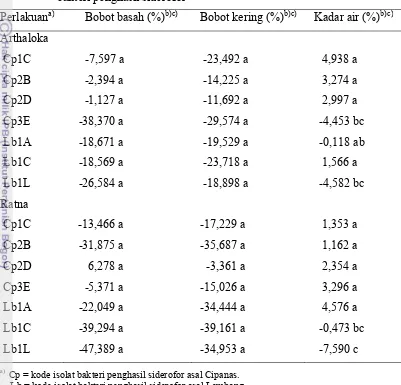
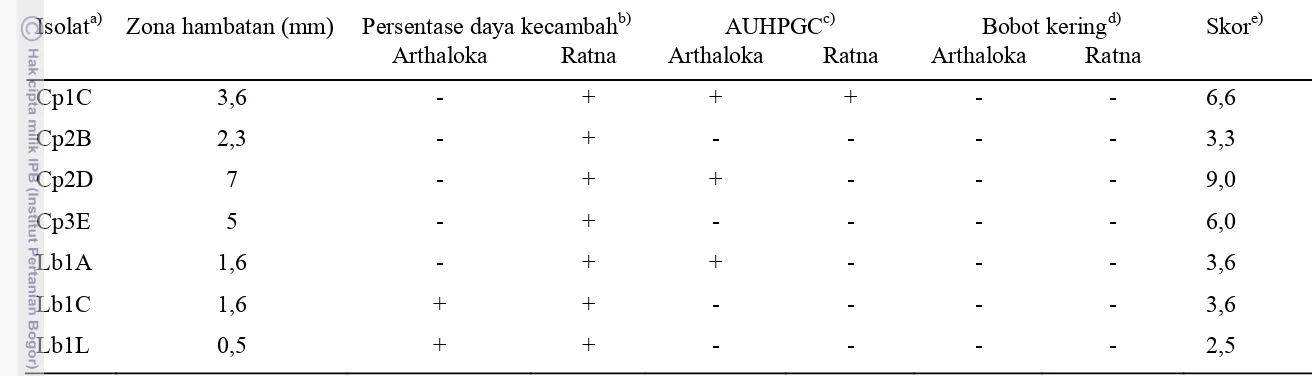
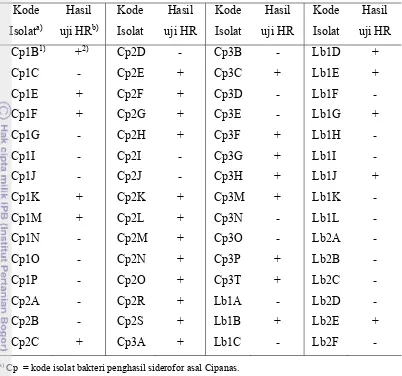
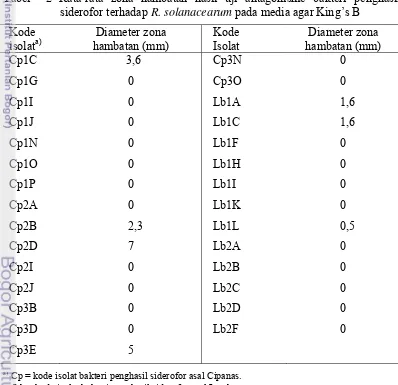
Pada Tabel 4 terlihat bahwa delapan isolat asal Cipanas membentuk zona bening (zona hambatan) dengan diameter rata-rata terpanjang sebesar 0,5 cm pada isolat BC4; 0,45 cm pada
Berdasarkan indeks similaritas antar isolat dan konstruksi dendogram, diketahui bahwa lima isolat bakteri termofilik penghasil enzim protease terpilih mempunyai
Hasil penelitian menunjukkan terdapat lima kelas toleransi yaitu kelas Sangat Toleran yang terdiri dari 6 genotipe yaitu tomat Mutiara, Opal, Cung, Syu dan Tomat Lokal Kudamati