Keefektifan Cendawan Endofit untuk Menekan Infeksi Chilli veinal mottle virus pada Tanaman Cabai (Capsicum annuum L.)
Teks penuh
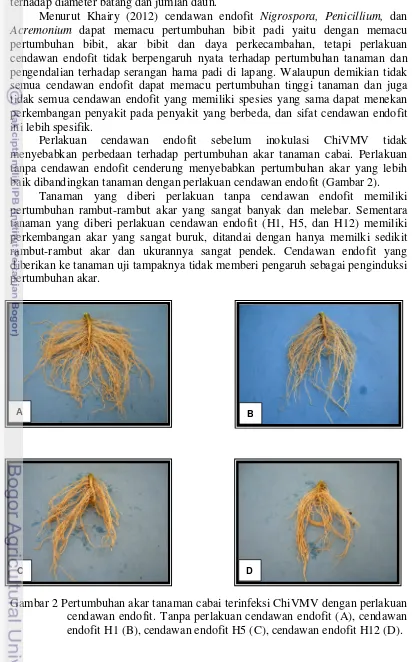
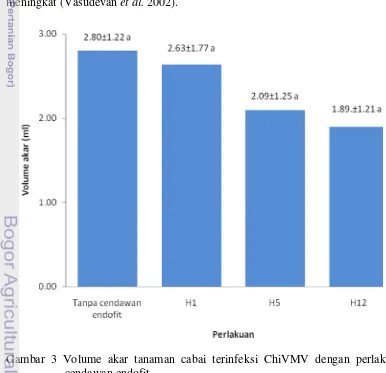
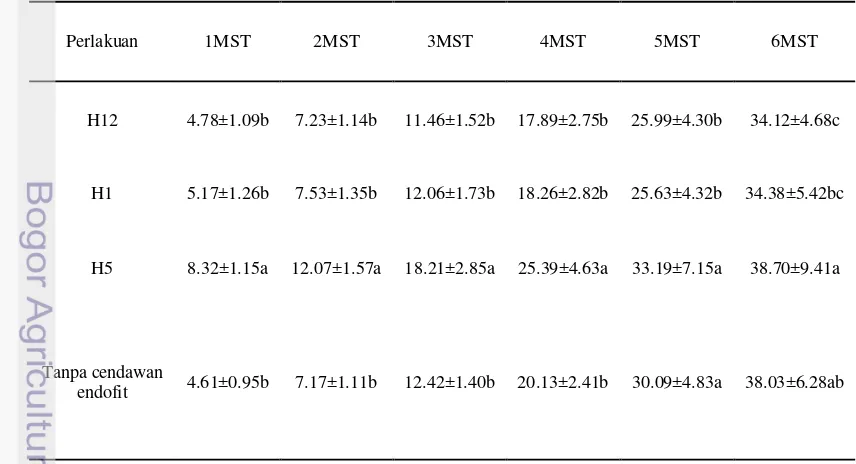
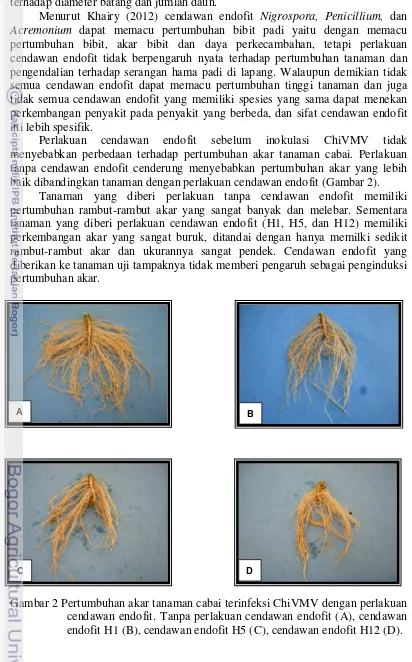
Gambar
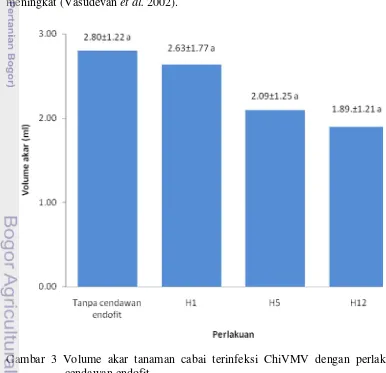
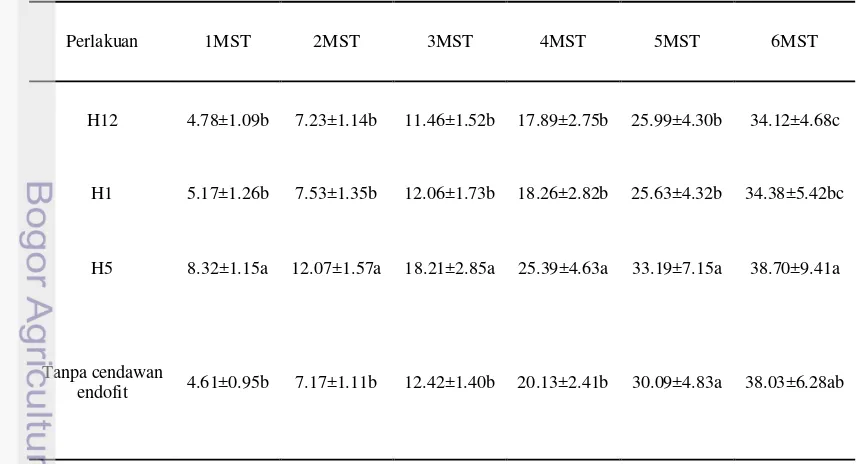
Dokumen terkait
Melihat kasus dan fenomena yang berkembang, khususnya pada perkembangan partai Nasdem dan orang-orang di dalamnya, serta strateginya dalam memanfaatkan memanfaatkan media
Ini berarti tidak terjadi perbedaan aktivitas perdagangan saham sebelum pemilihan presiden 9 Juli 2014 dan sesudah pemilihan presiden 9 Juli 2014 Hasil ini tidak berbeda
Selanjutnya penelitian ini dilakukan guna meningkatkan pemahaman konsep IPA pada materi gaya dan gerak menggunakan metode eksperimen dengan berbantukan media realia pada
Proses mekanik dilakukan setelah metode pulping semikimia dengan menggunakan alat disc refiner sebanyak 4,7, 10,13, dan 16 kali, hal ini bertujuan untuk fibrilasi
Pada perlakuan eksplan yang berasal dari PEG 4% yang dipindahkan pada medium induksi perakaran tanpa pemberian PEG memperlihatkan pertumbuhan yang pesat pada daun kedua
Skripsi yang berjudul: Penggunaan Teknik Jarimatika pada Pembelajaran Matematika di Lembaga Jarimatika Banjarmasin, ditulis oleh Ratna Riannoor telah diujikan dalam
Kesimpulan yang diperoleh dari penelitian ini adalah Aplikasi pembelajaran interaktif Mobile Application Development berbasis Android dapat dibuat dengan sifat dinamis,
Jumlah staf untuk program pengembangan sistem pengolahan limbah, pemberdayaan masyarakat, pengembangan pusat informasi dan aksi lingkungan, serta pendidikan