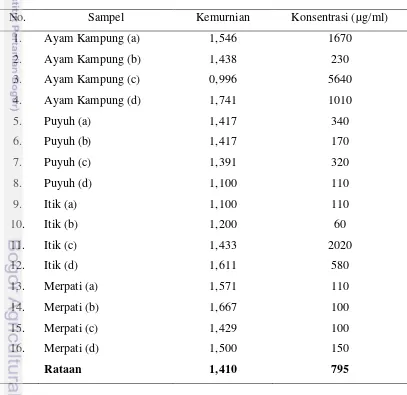
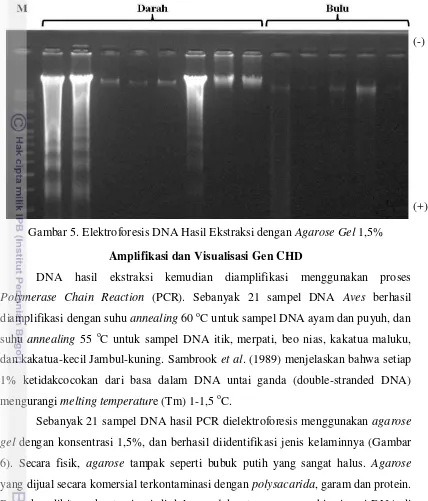
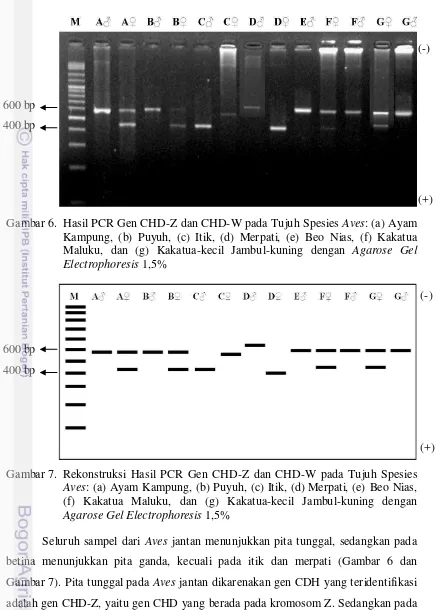
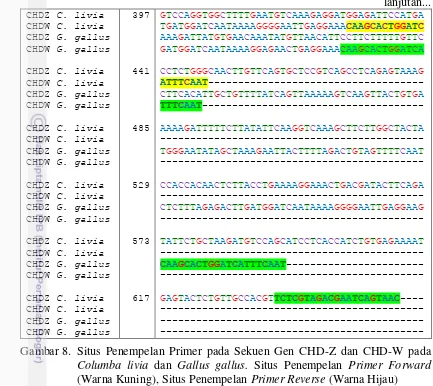
Penentuan Jenis Kelamin pada Kelas Aves Menggunakan Metode Polymerase Chain Reaction (PCR)
Teks penuh
Gambar




Dokumen terkait
1) Dapat membantu siswa untuk menumbuhkan motivasi belajar IPS. 2) Meningkatkan prestasi belajar siswa dengan kemampuan yang dimiliki oleh setiap siswa, serta
Ship Design and Construction, Robert Taggart, SNAME, 1980 1980 Introduction to Naval Architecture Thomas C. Gillmer and Bruce Johnson, Naval Institute Press
BUMA sebelumnya juga telah menandatangani kontrak dengan konsumen baru yakni PT Sungai Danau Jaya (SDJ) di akhir Juni lalu dimana total kontrak mencapai Rp5
Pemberian stimulasi kutan Slow stroke back massage pada daerah torakal 10 sampai 12 dan lumbal 1 yang merupakan sumber persarafan pada uterus dan cervik dapat merangsang
Produktivitas tenaga kerja wanita PT Apac Inti Corpora Bawen, pada unit garment memiliki produktivitas yang cukup baik dikarenakan dari 56 responden terdapat
Langkah 1: Tetapkan IRR untuk tiap proyek untuk mngeliminasi tiap project yang gagal memenuhi MARR.. Langkah 3: Bandingkan D1
Proses pengawasan memungkinkan tidak sesuai yang diharapkan karena faktor manusia, sehingga sangat mungkin terjadi pelanggaran jika dosen tidak memperhatikan dengan
Selanjutnya dalam kitab Al-Mudawwanah Imam Malik menyatakan bahwa seorang isteri pria mafqu d, apabila ia telah melewati masa empat tahun, dan juga telah habis masa