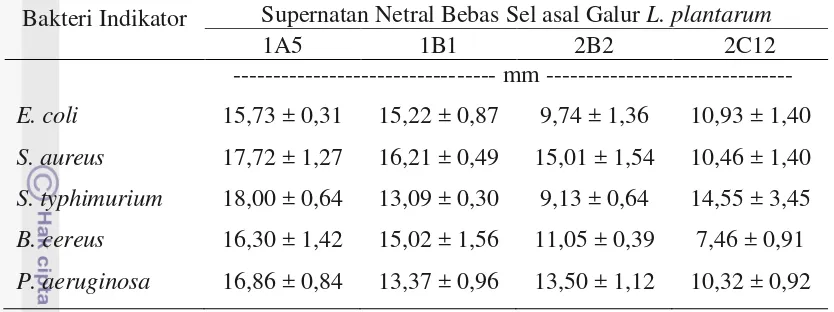
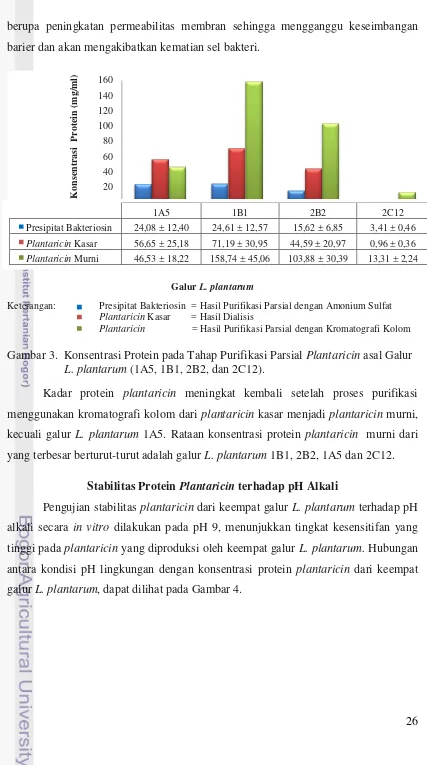
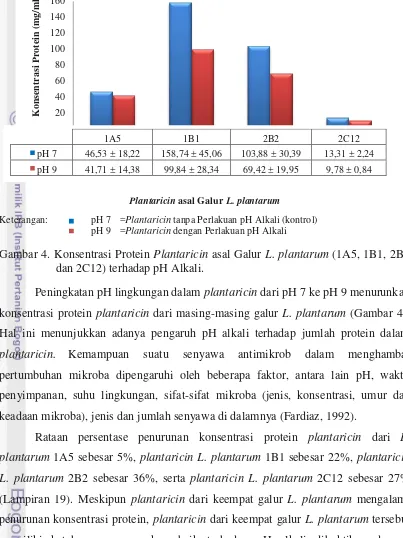
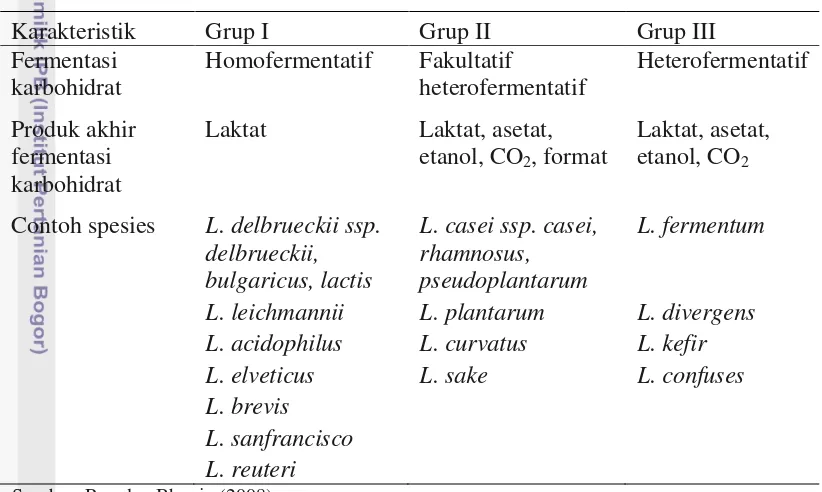
Stabilitas dan Aktivitas Antimikrob Plantaricin asal Galur Lactobacillus plantarum terhadap pH Alkali
Teks penuh
Gambar

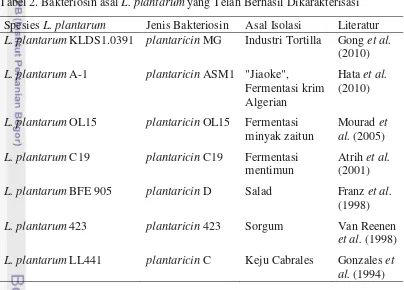

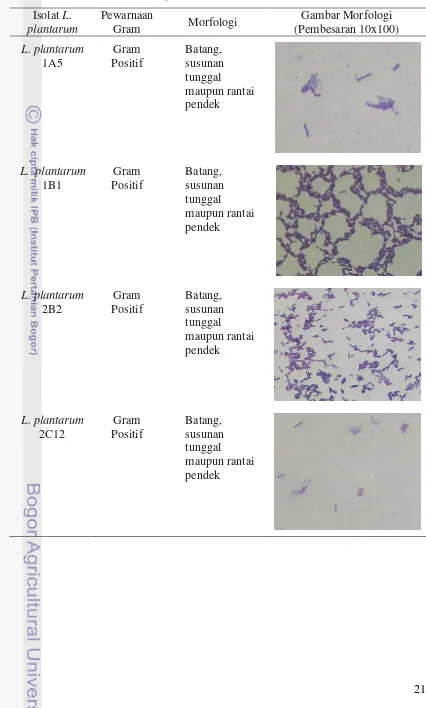
Dokumen terkait
Pada bagian ini pemrakarsa mengutarakan sumber data dan informasi yang digunakan dalam penyusunan Dokumen Pengelolaan Lingkungan Hidup (DPLH) Pembangunan Pasar Kota
Pasal 8 UUD 1945 ayat (1) dan ayat (2) mengatur tentang penggantian jabatan apabila Presiden dan/atau Wakil Presiden, yang salah satu memenuhi syarat untuk
Berdasarkan penelitian yang telah dilakukan dapat diperoleh bahwa keanekaragaman genetik Edelweiss dalam populasi baik di Gunung Lawu dan Merbabu tidak menunjukkan
Lembaga atau organisasi yang bekerjasama dalam praktek assessment antara lain, Dinas Sosial, Psikolog, Psikiater dan juga keterlibatan Pemerintah Pusat seperti,
engklek pada materi sistem pencernaan makanan. Penelitian ini menggunakan desain penelitian One Shot Case Study. Langkah-langkah pengembangan media yang digunakan dalam
iz 2014, rezultati ovoga istraživanja pokazuju da na smanjenje broja pušača najma- nje utječe ograničavanje oglašavanja i reklamiranja duhan- skih proizvoda te se znatno
Hasil penelitian analisis kesulitan materi (siswa kelas X Patiseri di SMK Negeri 9 Bandung) menunjukkan materi ilmu gizi yang paling sulit dipahami adalah materi
Namun demikian kenyataannya yang terjadi dalam lingkungan anggota militer terdapat sebuah kebijakan adanya ketetapan kafaah dengan memperhatikan pangkat atau pekerjaan