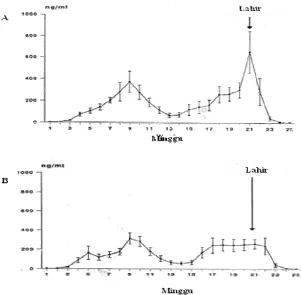
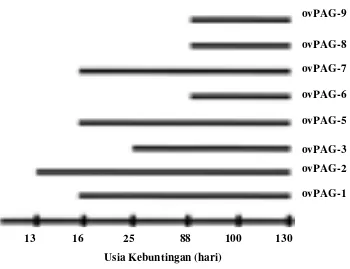
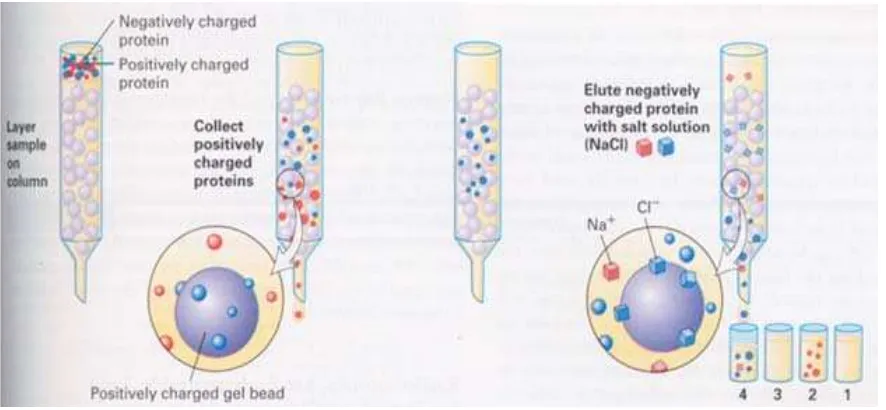
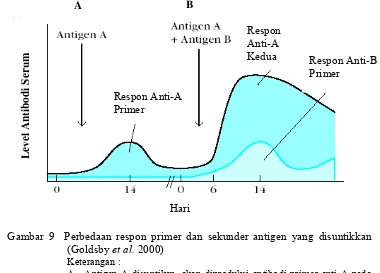
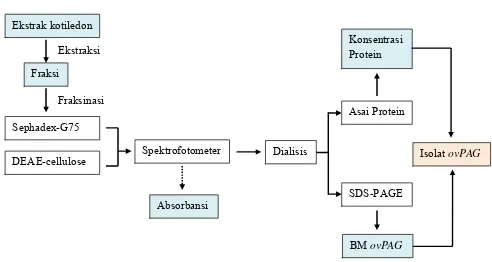
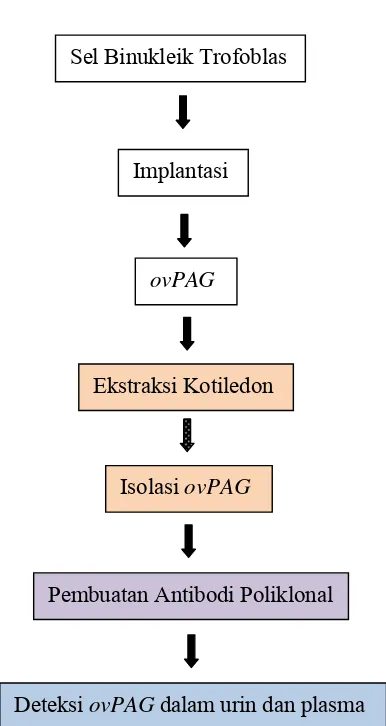
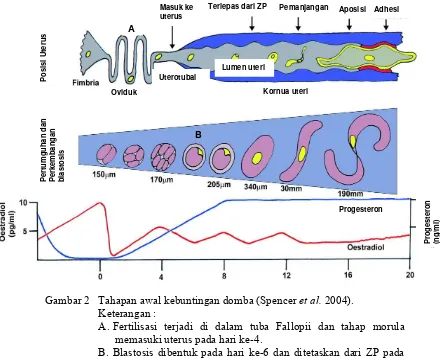
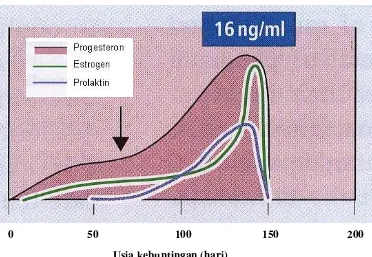
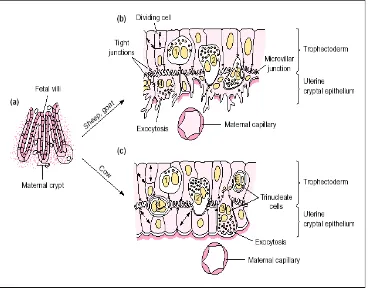
Ovine Pregnancy Associated Glycoprotein (ovPAG) as a marker of pregnancy on Garut Sheep
Teks penuh
Gambar
Dokumen terkait
[r]
Peningkatan tersebut didukung keterampilan guru dalam mengelola pembelajaran siklus I (73%), menjadi siklus II (84%) melalui model pembelajaran make a match dapat
Mengingat pentingnya pembuktian kualifikasi ini diharapkan kepada Bapak/Ibu Pimpinan Perusahaan atau yang diwakilkan dengan menunjukkan Surat Kuasa untuk
Sumber : Anonim, 1997, Konsep Laporan Akhir Penyusunan Rencana Detail Kawasan Ratu Boko Tahap II, hal: II - 20. Tabel 7 : TeIjemahan Arsitektural Vegetasi Kawasan
Trichoderma yang dikultur dapat tumbuh cepat pada suhu 25-30 °C, namun pada suhu 35 °C cendawan ini tidak dapat tumbuh.. Perbedaan suhu mempengaruhi produksi beberapa enzim
Kualitas adalah suatu konsep yang luas, sehingga dalam melakukan pengkajian kualitas pelayanan kesehatan perlu diperhatikan berbagai dimensi dari kualitas pelayanan
Keterlibatan Pemuda Pancasila dalam Pilkada Surabaya merupakan sebuah bentuk tanggung jawab Pemuda Pancasila sebagai ormas menjaga proses politik yang ada di
3) Melatih siswa untuk bertanggung jawab dan mendorong untuk membangun kepentingan bersama. Partisipasi siswa dalam pembelajaran sangat penting untuk menciptakan