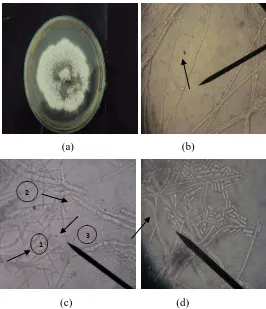
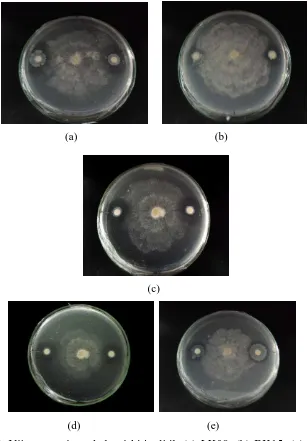
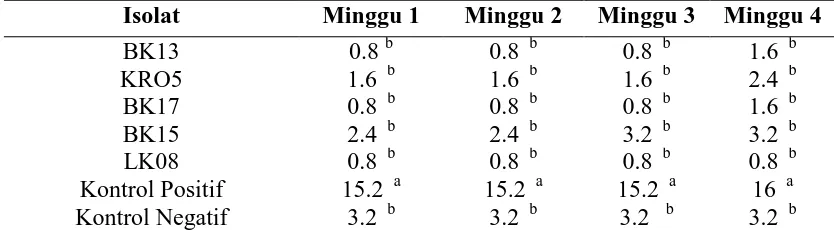
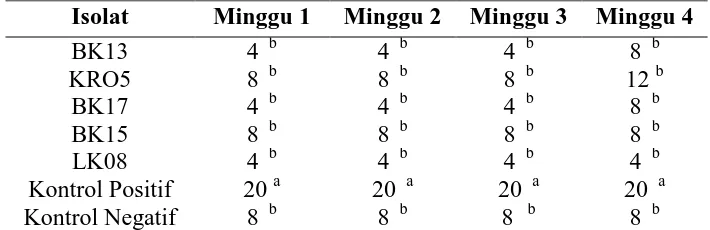
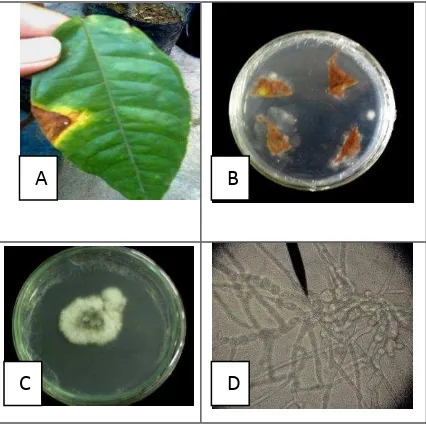
Pengendalian Serangan Colletotrichum sp. Pada Tanaman Kakao (Theobroma cacao L.) Menggunakan Isolat Bakteri Kitinolitik
Bebas
73
0
0
Teks penuh
Gambar


+7
Dokumen terkait