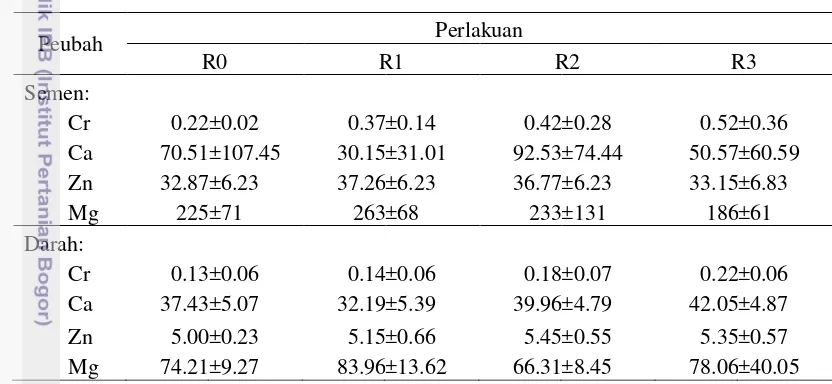
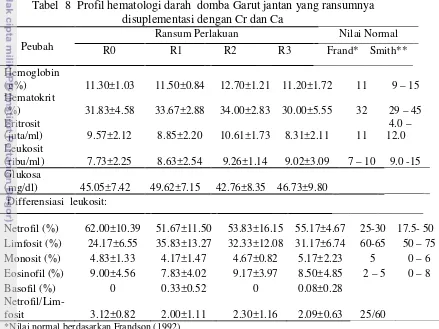
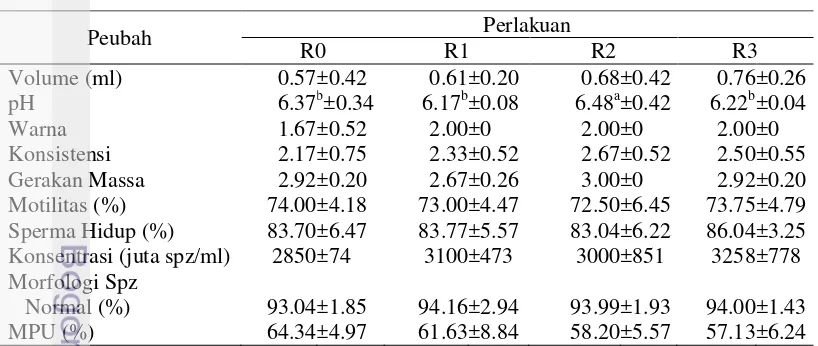
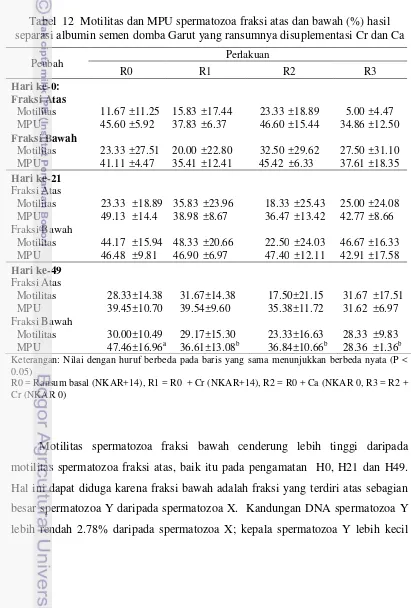
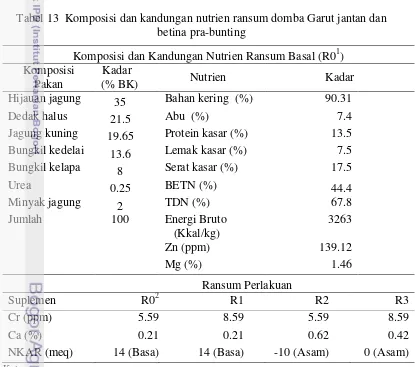
Performa produksi dan reproduksi domba garut yang mendapat ransum bersuplemen kromium, kalsium dan bernilai kation anion berbeda
Teks penuh
Gambar
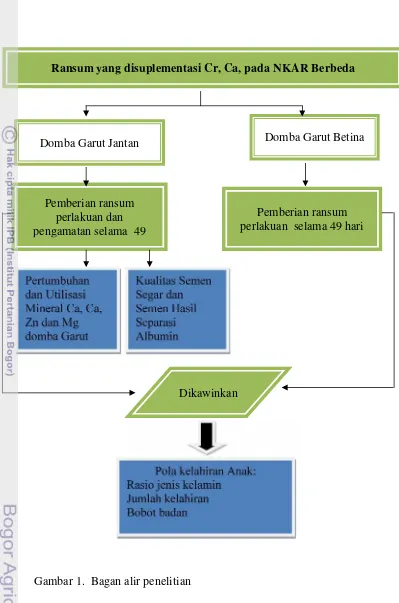
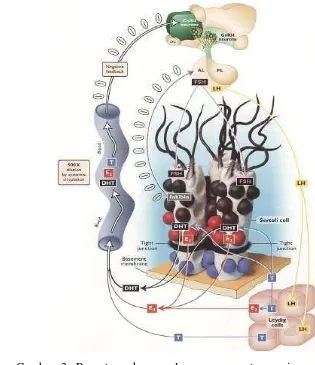
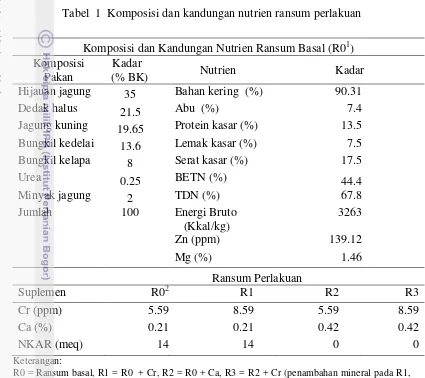

Dokumen terkait
[r]
Berdasarkan tabel di atas dapat diketahui bahwa sebanyak 62 responden atau 62% memberikan jawaban sangat setuju dengan penelitian yang diajukan oleh peneliti
Rule yang dipilih bisa lebih dari satu sesuai dengan karakteristik data yang akan diterapkan topology.. Lihat ilustrasi
“(2) Wajib Pajak Orang Pribadi yang melakukan kegiatan usaha atau pekerjaan bebas yang peredaran brutonya dalam 1 (satu) tahun kurang dari Rp 4.800.000.000,00 (empat
[r]
Perkiraan Tanggal Terakhir perdagangan IDKM di Bursa 24 April 2013 Tanggal Efektif Penggabungan 01 Mei 2013 Perkiraan Tanggal Perdagangan saham di Bursa hasil Penggabungan 06
Berdasarkan uraian sebelumnya, dapat disimpulkan bahwa pembelajaran IPA merupakan suatu kegiatan baik di dalam ataupun di luar kelas yang dilakukan oleh pendidik (guru)
Merupakan prioritas utama yang perlu diperhati- kan dalam menilai pentingnya kualitas pelayanan suatu perusahaan, adalah sejauh mana pelayanan itu dapat menciptakan tingkat